
����Ŀ�������ȱ����һ�ֶ�Ͱ��������ϼ����ٴ��ж�����;����������������ȱ���Ʊ���ԭ�ϣ����ɻ�����I�͢���ͭ�����������·�Ӧ�Ƶá�

(1) Cu��̬��������Ų�ʽΪ________________��
(2) 1 mol�����������к���������ĿΪ________��
(3) ������������sp3��ʽ�ӻ���ԭ����Ŀ��____________��
(4) ��[Cu(NH3)4]SO4��Һ��ͨ��SO2�����ԣ��а�ɫ�������ɡ����������ð�ɫ������Cu��S��N�����ʵ���֮��Ϊ1��1��1����������һ�������ε������Ӻ�һ�����������ε������ӡ�
��[Cu(NH3)4]SO4�д��ڵĻ�ѧ��������________(����ĸ)��
A. ���ۼ���B. �����C. ���Ӽ���D. ��λ����E. ���Ӽ�������
�� ������ɫ�����Ļ�ѧʽΪ____________________________��
(5) ͭ���⻯��ľ���ṹ��ͼ��ʾ��д�����⻯����������ȼ�յĻ�ѧ����ʽ��__________________________________________________________��

���𰸡�[Ar]3d104s1 14 mol 2 ACD Cu(NH4)SO3 2CuH��3Cl2===2CuCl2��2HCl
��������
�ݵ����Ų�����д�����Ų�ʽ���ɼ���ʽ������ʱ������©C-H���ɼ۲���Ӷ���ȷ���ӻ����ͣ��������Ĺ��ɺ��γ��жϻ�ѧ�����ɾ������㻯ѧʽ������д��ѧ����ʽ��
(1) Cu�����Ų����Ϻ��ع������������̬��������Ų�ʽΪ[Ar]3d104s1��
(2)�����ϵ�̼̼����̼�������������1 mol�������������к���������ĿΪ14mol��
(3)�������������У���ԭ�Ӻ��Ȼ��е��ǻ����۲���ӶԶ���4�ԣ����Dz���sp3�ӻ���ʽ�ɼ���
(4) ��[Cu(NH3)4]SO4�У�[Cu(NH3)4]2+��SO42��֮�������Ӽ���NH3��SO42���ڲ����й��ۼ���Cu2+��NH3����λ����ϣ���ѡACD��
�����ж������ε�������ΪSO32�������������ε�������ΪNH4+������й����ʵ���ɣ���ɫ�����Ļ�ѧʽΪCu(NH4)SO3��
(5)ͭ���⻯��ľ�����Cu��Hԭ�Ӹ���4�����仯ѧʽΪCuH������������ȼ�յĻ�ѧ����ʽ2CuH��3Cl2��2CuCl2��2HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�����γɵ��ʼ��仯������������Ԫ�ء��ش��������⣺
��1��̼�����⡢����������Ԫ�ع��ɻ�����CO(NH2)2���÷����и�Ԫ�صĵ縺���ɴ�С��˳��Ϊ_________������Cԭ�ӵ��ӻ���ʽΪ__________��������������ˮ����Ҫԭ����_______________��
��2��CO��̼Ԫ�صij����������N2��Ϊ�ȵ����壬��CO�ĽṹʽΪ_______��CO���Ժͺܶ���ɽ����γ�������Ni(CO)4��д����̬Niԭ�ӵĵ����Ų�ʽ__________��
��3��̼��ij�־���Ϊ��״�ṹ���������ڽ��������á���ԭ������ڸ���֮�䣬�γɼ�϶������䳣���ṹ��ƽ��ͶӰ��ͼ����ʾ�����仯ѧʽ�ɱ�ʾΪ__________

��4��ͼ��Ϊ̼��һ��ͬ��������C60���ӣ�ÿ��C60�����к�����������ĿΪ________��
��5��ͼ��Ϊ̼����һ��ͬ����������ʯ�ľ���������ԭ���������AΪ��0��0��0����BΪ��1/2��0��1/2����CΪ��1/2��1/2��0������Dԭ�ӵ��������Ϊ__________��
��6��������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5 pm��������������ܶ���___________g���M-3���г�����ʽ���ɣ������ӏ�����ΪNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƥ�����ʼ�����;��
���� ��;
A. �������� a.�����������������
B. ̼������ b.Ư��������
C. ������ c.��۷��ͷ�
D .�������� d.��ɫ�����Ϳ��
A. _______________��
B. _______________��
C. _______________��
D. _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����CO����������(NOx) ����Ӱ�����ǵ�����ͽ�������ѧ�����߶Ե�������Ĵ������˹㷺�����˵��о���
I.���ü��黹ԭNOX
��CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) ��H1=-574kJ/mol ��
��CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) ��H2=-1160 kJ/mol ��
��1��������ӽ�NO2 ��ԭΪN2���Ȼ�ѧ����ʽΪ________________________��
��2���ں���(2L)�ܱ������г���1molCH4��2moINO2���У�1���з�Ӧ��CH4��ƽ��ת���ʦա�(CH4)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ����ʾ��
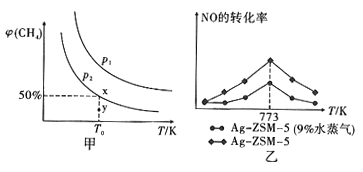
���������е�ѹǿΪp2��y �㣻 v ��_____V��(�����"�����ڡ���С�ڡ�)��
��ͼ��ѹǿ��СP1_______ P2
��X ���Ӧ�¶��·�Ӧ��ƽ�ⳣ��K=_____ ��
II.ij�о�С����Ag-ZSM-5Ϊ����ģ������β���Ĵ�����ʵ��NO��CO��Ӧת��Ϊ�����塣ͬʱ���÷�Ӧ�ų�������Ԥ��NO ��CO��ʵ����NO��ת�������¶ȵı仯��ͼ����ʾ��
��1������773K��NO��ת���ʽ��͵Ŀ���ԭ����______________������ţ���
A.ƽ�ⳣ����� B.�����Ļ��Խ��� C.��Ӧ�������
��2��Ϊ�������β����NO��ת���ʣ����˸ı��¶ȡ�ѹǿ�⣬�����Բ�ȡ�Ĵ�ʩ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ����ȷ���ǣ� ��
A.ˮ����������ɱ�������������
B.�ռ�����ʯ�Ҷ����ڼ�
C.H2SO4��HNO3��H2CO3��������
D.NaHSO4��CuSO4��5H2O��KMnO4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ʵ������ȡ������������Ϊԭ�Ͻ���һϵ�з�Ӧ��װ�ã��ش��������⡣����֪����MnO2+4HCl(Ũ) ![]() MnCl2+2H2O+Cl2��,��Cl2+SO2+2H2O��2HCl+H2SO4,�� Ba(OH)2+CO2��BaCO3��+H2O��
MnCl2+2H2O+Cl2��,��Cl2+SO2+2H2O��2HCl+H2SO4,�� Ba(OH)2+CO2��BaCO3��+H2O��

��1���a����������___��
��2��װ��D������ɫ���������ԭ��___________��
��3��Eװ�õ�Ӳ�ʲ�������ʢ��̼�ۣ�����������ԭ��Ӧ�������ΪCO2��HCl����д��E�з�Ӧ�Ļ�ѧ����ʽ_______��
��4��F�����ձ���Һ������___����С���û�С�����ɫ������
��5��Fװ����ȷ��E����Ӧ����CO2������Ϊ��֤��CO2�Ĵ��ڣ�Ҫ��Fװ�ý��и��죬����װ�÷���Ҫ�����___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ�װ��ͼ����������ȷ����
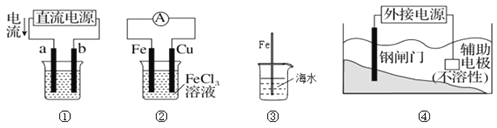
A. ��װ�âپ���ͭ����a��Ϊ��ͭ���������ҺΪCuSO4��Һ
B. װ�âڵ��ܷ�Ӧʽ:Cu+2Fe3+==Cu2++2Fe2+
C. װ�â��в��뺣ˮ�е�������Խ�����˸�ʴԽ����
D. װ�â��и�բ��Ӧ����ӵ�Դ�ĸ����������������÷���������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊȼ�ϵ�����ȼ�ϵ�ؼ���ʢ����������ͭ��Һ��װ������������ʼ��·����״����ͼ�Ե���ǿ��0.1A��ͨ��10min����ص����������������룬�ƶ��������������Ե�ǿ��0.2A������ͨ��10min������ʵ�顣�����й�˵����ȷ����

A. ��������װ�ü������μӷ�Ӧ�������ڸ���μӷ�Ӧ
B. �ڸõ�ط�Ӧ�У�ÿ����1mol���������������ɱ�״���¶�����̼11.2L
C. ��ع���20minʱ����װ�õ缫��������͵缫�ϲ��������������Ϊ2��1
D. ��ع���15����ʱ����װ����ͭ������������ʼͨ��ǰ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������⣬�����¡��״�������ú����Һ������壬������ȼ�ϵ�ص�ȼ��������֪��ȼ��ʱ�������з�Ӧ��N2H4+O2![]() N2+2H2O����PtΪ�缫��������Ϊ�������Һ�����ȼ�ϵ�أ����й�����ȼ�ϵ�ص�˵���в���ȷ�� )
N2+2H2O����PtΪ�缫��������Ϊ�������Һ�����ȼ�ϵ�أ����й�����ȼ�ϵ�ص�˵���в���ȷ�� )
A. ����ȼ�ϵ�صĸ�����Ӧ�O2��������Ӧ��
B. ��ȼ�ϵ�ص�������ӦΪ O2 + 2H2O + 4e��= 4OH��
C. ��ȼ�ϵ�صĸ�����ӦΪ��N2H4 ��4e��=N2��+4H+
D. ��ع���������H+�������ƶ�����H+���ʵ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com