
分析 A、B、C、D是元素周期表中前四周期的元素,其中A元素p电子总数比s电子总数少1,则A含有4个s电子、3个p电子,原子序数为7,是N元素;B元素p电子总数与s电子总数相等,且原子半径比A小,B含有4个s电子和4个p电子,为O元素;C元素原子3p能级上只有一对成对电子,C的3p轨道含有5个电子,M层含有7个电子,为Cl元素;D元素原子N层上只有1个电子,且次外层的电子充满在2个能级中,则D为K元素,据此进行解答.
解答 解:A、B、C、D是元素周期表中前四周期的元素,其中A元素p电子总数比s电子总数少1,则A含有4个s电子、3个p电子,原子序数为7,是N元素;B元素p电子总数与s电子总数相等,且原子半径比A小,B含有4个s电子和4个p电子,为O元素;C元素原子3p能级上只有一对成对电子,C的3p轨道含有5个电子,M层含有7个电子,为Cl元素;D元素原子N层上只有1个电子,且次外层的电子充满在2个能级中,则D为K元素,
(1)根据分析可知,A为氮元素,D为钾元素,
故答案为:氮;钾;
(2)元素A、B可以形成A2B型共价化合物为N2O,N2O分子中含有3个原子、22个电子,与N2O互为等电子体的为CO2,
故答案为:CO2;
(3)A为N元素,B为O元素,N元素2p轨道为半充满状态,较稳定,其第一电离能大于O,
故答案为:>;
(4)B和C元素对应的气态氢化物分别为H2O、HCl,由于水分子间形成氢键,导致其沸点大于HCl,
故答案为:H2O;水分子间形成氢键.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 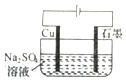 装置可实现:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 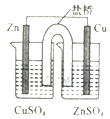 装置能构成锌铜原电池 | |
| C. | 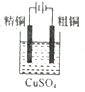 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于浓硫酸干燥氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| D. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2O2中只含有极性共价键,不含离子键 | |
| B. | 2NO2?N2O4的平衡常数K随温度升高而减小 | |
| C. | 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 | |
| D. | H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 乙醇、苯和溴苯用水即可鉴别 | ||
| C. | 汽油、柴油、植物油都是碳氢化合物 | D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Cu2+、Cl-、CO32- | |
| B. | 0.1 mol•L-1 AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- | |
| C. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- | |
| D. | 1.0mol/LKNO3溶液中:Fe2+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
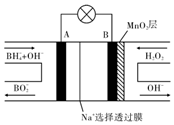 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com