
【题目】对于反应N2+3H2 ![]() 2NH3,下列说法处于化学平衡状态的是( )
2NH3,下列说法处于化学平衡状态的是( )
①υ(N2)正=υ(N2)逆,
②N2、H2、NH3的分子数之比为1∶3∶2,
③单位时间内生成2molNH3,同时消耗1molN2,
④N2、H2、NH3的物质的量不再发生变化。
A. ①④B. ②③C. ②③④D. ①③④
【答案】A
【解析】
化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
①υ(N2)逆是逆反应,υ(N2)正是正反应,υ(N2)正=υ(N2)逆,正、逆反应速率相等,可作为判断是否达到化学平衡状态的依据,①正确;
②平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故N2、H2、NH3的分子数之比为1:3:2不能作为判断是否达到平衡状态的依据,②错误;
③单位时间内生成2molNH3是正反应,同时消耗1molN2也是正反应,故单位时间内生成2molNH3,同时消耗1molN2不能作为判断是否达到化学平衡状态的依据,③错误;
④平衡时,各物质的浓度不再发生变化,故N2、H2、NH3的物质的量不再发生变化可作为判断是否达到化学平衡状态的依据,④正确;故可判断反应处于化学平衡状态序号是①④,
因此合理选项是A。


科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是

A. 最简单氢化物的沸点排序:Y>T>R
B. 原子半径和离子半径均满足:Y<Z
C. 最高价氧化物对应的水化物的酸性:T<R
D. 单质氧化性:Y>R>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g)![]() 2HI(g)△H=﹣9.48kJ/mol
2HI(g)△H=﹣9.48kJ/mol
(ii) I2(S)+H2(g)![]() 2HI(g)△H=+26.48kJ.
2HI(g)△H=+26.48kJ.
A. 1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是
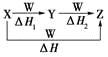
①C、CO ②S、SO2③AlCl3、Al(OH)3④Na2CO3、NaHCO3⑤Fe、FeCl2
A. ①②③④⑤B. ②④⑤
C. ①③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某传感器工作原理如图所示。利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是
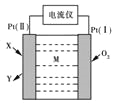
A. 传感器工作中,电子由Pt(Ⅰ)极经电流仪传到Pt(Ⅱ)极
B. 若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e- = N2+6H+
C. 若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2 + 4e- = 2O2-
D. 若X为CO,M为KOH溶液,则电池总反应为2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能获得成功的是
①将醋酸钠晶体与碱石灰混合加热来制取甲烷;
②将乙醇与浓硫酸共热至140°C来制取乙烯;
③在电石中加水制取乙炔;
④苯、浓溴水和铁粉混和,反应后可制得溴苯;
A.只有②B.只有①②C.只有①②④D.只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向![]() 溶液中滴加HI溶液:
溶液中滴加HI溶液:![]()
B. 用铜电极电解氯化钠溶液:![]()
C. 向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
D. 向![]() 溶液中滴加稀盐酸:
溶液中滴加稀盐酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)画出磷原子的原子结构示意图:______。
(2)写出H2S分子的电子式:________。
(3)写出表示含有8个质子,10个中子的原子的化学符号:______。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a=____。
(5)用电子式表示氯化镁的形成过程:____。
(6)写出Na2O2中所含化学键的类型______。
(7)拆开1mol H—H键,1mol N—H键, 1mol![]() 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
(8)利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:___;正极__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com