
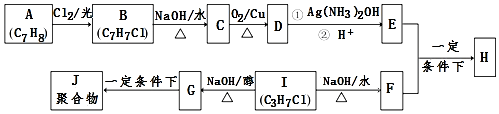
 .
. .
.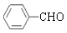 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.分析 A属于芳香烃,分子式为C7H8,则A为 ,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为
,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C发生催化氧化生成D为
,C发生催化氧化生成D为 ,D与银氨溶液反应、酸化得到E为
,D与银氨溶液反应、酸化得到E为 .I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为
.I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为 .I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为
.I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为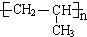 ,以此来解答.
,以此来解答.
解答 解:(1)通过以上分析知,E为 ,含有官能团为羧基,B的结构简式为
,含有官能团为羧基,B的结构简式为 ,故答案为:羧基;
,故答案为:羧基; ;
;
(2)B→C和G→J两步的反应类型分别为取代反应、加聚反应,故答案为:取代反应;加聚反应;
(3)①E+F→H的化学方程式为 ,
,
②D与银氨溶液反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O,
+2Ag↓+3NH3+H2O,
故答案为: ;
; +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(4)I(CH3CHClCH3)的同系物K比I相对分子质量大28,则K的分子式为C5H11Cl,
①可以看作C5H12被取代产物,正戊烷被取代有3种,异戊烷被取代有4种,新戊烷被取代有1种,故K的同分异构体有8种,
故答案为:8;
②若K不能发生消去反应,则K的结构简式为(CH3)3CCH2Cl,
故答案为:(CH3)3CCH2Cl.
点评 本题考查有机物的推断与合成,为高频考点,把握有机物的官能团与性质、有机反应为解答的关键,侧重分析与推断能力的考查,注意合成流程中官能团的变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A和B的相对分子质量之差为168 | |
| B. | B一定不能发生加成反应 | |
| C. | 有机物B与CH3CH2OH互为同系物 | |
| D. | 分子式为C5H10O2且与CH3COOH属于同类物质的有机物只有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 氢氧化铝可与盐酸反应 | 氢氧化铝可用于治疗胃酸过多 |
| D | 冷的浓硝酸与铁不发生反应 | 可以用铁槽车储运浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体总质量保持不变 | B. | 消耗Z的速率与消耗X的速率相等 | ||
| C. | X、Y、Z的浓度不再发生变化 | D. | X、Y、Z的分子数之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
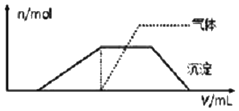 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Al3+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
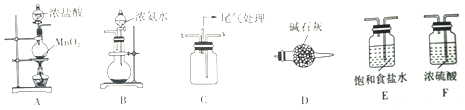
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (填结构简式)
(填结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com