
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
分析 A.二氧化硅具有对光良好的全反射作用,可用于制光导纤维;
B.浓硫酸具有吸水性,可作干燥剂;
C.漂白粉在空气中与水、二氧化碳反应生成HClO,HClO可漂白纸张;
D.熔点高的物质可作耐火材料.
解答 解:A.二氧化硅具有对光良好的全反射作用,可用于制光导纤维,与二氧化硅能与氢氟酸反应无因果关系,故A错误;
B.浓硫酸具有吸水性,可作干燥剂,干燥氯气与脱水性无关,故B错误;
C.漂白粉在空气中与水、二氧化碳反应生成HClO,HClO可漂白纸张,HClO不稳定易光照分解,故C错误;
D.熔点高的物质可作耐火材料,则氧化铝熔点很高,可用于制耐火材料,故D正确;
故选D.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、发生的反应、化学与生活等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
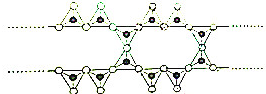 在结构中,
在结构中,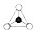 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
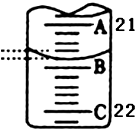 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z | B. | 非金属性:X<Y<Z | ||
| C. | 原子半径:X<Y<Z | D. | 原子得电子能力:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题: .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
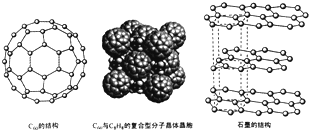
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的4个碳氢键的键能相等 | B. | 甲烷的4个碳氢键的键长相等 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷的二氯代物只有1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com