
| A、①③ | B、①④ | C、②④ | D、②③ |
| m |
| M |
| 11g |
| 22g |
| 11g |
| 22g |
| 26.5g |
| 106g/mol |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
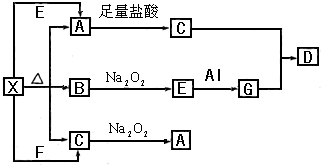 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
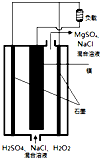 镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池是具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示,关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 |
| B、电池工作时,H+向Mg电极移动 |
| C、电池充电时,Mg应与电源的负极相连 |
| D、电池工作时,正极周围溶液的pH将不断变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活化分子的总数越多,反应速率越快 |
| B、升高温度,活化分子百分数不变,活化分子数增多,化学反应速率增大 |
| C、使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大 |
| D、加入反应物,使活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2=Cu+Cl2↑ |
| B、H2SO4=2H++S6++4O2- |
| C、Na2CO3=2Na++CO32- |
| D、Ba(OH)2=Ba+2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com