
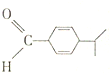
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断.注意单键可以旋转.
解答 解:在 分子中,环中与醛基所连得C原子处于甲醛中H原子的位置,左边次甲基通过旋转碳碳单键会有环中的1个双键中1个C原子处在醛基平面内,醛基平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,右边次甲基通过旋转碳碳单键会有次甲基所连的2个C原子处在碳碳双键形成的平面内,所以最多有7个C原子共面,故答案为:7.
分子中,环中与醛基所连得C原子处于甲醛中H原子的位置,左边次甲基通过旋转碳碳单键会有环中的1个双键中1个C原子处在醛基平面内,醛基平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,右边次甲基通过旋转碳碳单键会有次甲基所连的2个C原子处在碳碳双键形成的平面内,所以最多有7个C原子共面,故答案为:7.
点评 本题考查有机物结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯的结构特点判断有机分子的空间结构,单键可以旋转.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
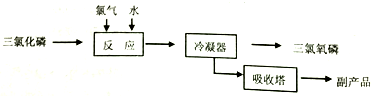
 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- | |
| B. | 向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- | |
| C. | 向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ | |
| D. | 向某无色溶液中加浓NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则说明原溶液中一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.
工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.2mol H2SO4的浓硫酸与足量Cu在加热条件下反应,生成SO2的分子数为0.1NA | |
| B. | 标准状况下11.2L O3和CO2混合气体中含原子数为1.5NA | |
| C. | 100mL 2mol•L-1的NaHSO3溶液中,HSO3-和SO32-数目之和为0.2NA | |
| D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,生成1.5mol Cl2转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 22.4L氯气和氢气的物质的量都是1mol | |
| B. | 1mol氯气和氢气的体积都是22.4L | |
| C. | 标准状况下22.4L氯气的物质的量为1mol | |
| D. | 标准状况下1mol氢气的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
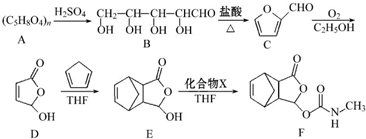
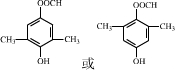 .
.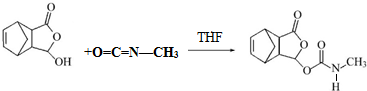 .
.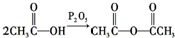 .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以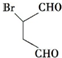 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下: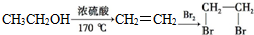
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com