
| A. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| B. | 已知101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则该反应的反应热为221 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量 | |
| D. | 已知HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ•mol-1 |
分析 A.根据燃烧热的定义判断热化学方程式;
B.应指明反应为吸热反应还是放热反应;
C.醋酸为弱酸,电离吸热;
D.浓硫酸溶于水放热.
解答 解:A.燃烧热是指完全反应生成稳定的氧化物,生成的水为液态,所以葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1,故A正确;
B.应指明反应为吸热反应还是放热反应,故B错误;
C.醋酸为弱酸,电离吸热,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出的热量小于57.3 kJ,故C错误;
D.浓硫酸溶于水放热,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热小于-57.3 kJ•mol-1,故D错误.
故选A.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,为高频考点,侧重考查学生的分析能力,注意把握燃烧热、中和热等定义的理解,难度不大,把握热化学方程式的书写方法.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 2d | B. | 2.5d | C. | 5d | D. | 0.8d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
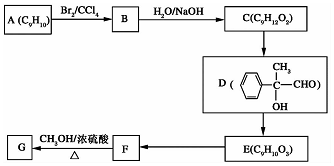
 .
.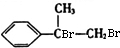 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$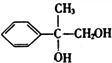 +2NaBr
+2NaBr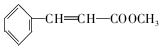 互为同分异构体
互为同分异构体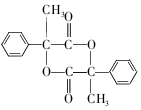 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.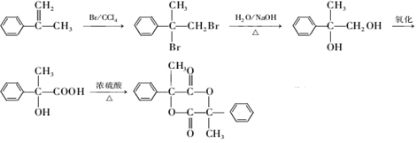 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
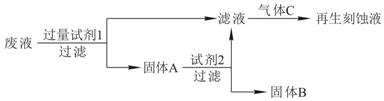
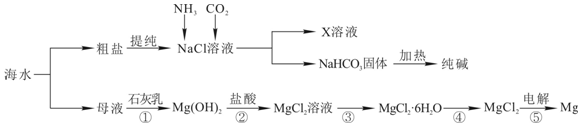
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +7 | B. | +2 | C. | +6 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | 钠 | 水 | 硝酸 | 小苏打 | 胆矾 |
| B | 生铁 | 硅酸钠 | H2SiO3 | KOH | NH4Cl |
| C | 晶体硅 | 过氧化钠 | 盐酸 | '纯碱 | 明矾 |
| D | 液氯 | 铁红 | 硫酸 | Ca(OH)2 | Na2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-7 mol/L | B. | 1.0×107 mol/L | C. | $\frac{0.1}{a}$mol/L | D. | $\frac{0.1b}{a+b}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
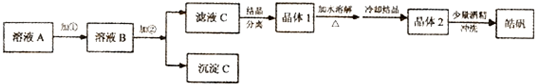
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com