
分析 (1)氧化铁可以用作防锈漆、进行炼铁等;
(2)铁离子水解得到氢氧化铁胶体与氢离子;若向氢氧化铁胶体中滴加氢碘酸,然后滴加2滴淀粉溶液,胶体聚沉后溶解发生氧化还原反应,铁离子氧化碘离子生成碘单质;
(3)①FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$;
②书写热化学方程式,结合盖斯定律计算得到所需热化学方程式;
(4)0.1mol/L的NH4Fe(SO4)2溶液中硫酸根离子浓度最大,铵根离子水解程度和铁离子水解溶液显酸性,但二者程度相比较,铵根离子水解程度小.
解答 解:(1)氧化铁可以用作作涂料、防锈漆、进行炼铁等,故答案为:作涂料、防锈漆、炼铁;
(2)利用FeCl3溶液制备氢氧化铁胶体的离子方程式:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe (OH)3(胶体)+3H+,若向氢氧化铁胶体中滴加氢碘酸,然后滴加2滴淀粉溶液,胶体聚沉后溶解发生氧化还原反应,铁离子氧化碘离子生成碘单质,遇到淀粉变蓝色,先产生沉淀,然后沉淀溶解,加入淀粉后溶液颜色变蓝,
故答案为:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe (OH)3(胶体)+3H+; 先产生沉淀,然后沉淀溶解,加入淀粉后溶液颜色变蓝;
(3)①FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=4:1,
故答案为:4:1;
②Ⅰ.FeO(s)+CO(g)?Fe(s)+CO2(g)△H=+463kJ/mol,
Ⅱ.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-545kJ/mol,
盖斯定律计算Ⅰ×2-Ⅱ×2得到:2FeO (s)?2Fe(s)+O2(g)△H=+2016kJ/mol,
故答案为:+2016kJ/mol;
(4)0.1mol/L的NH4Fe(SO4)2溶液中硫酸根离子浓度最大,铵根离子水解程度和铁离子水解溶液显酸性,但二者程度相比较,铵根离子水解程度小,溶液中离子浓度大小为:SO42->NH4+>Fe3+>H+>OH-,
故答案为:SO42->NH4+>Fe3+>H+>OH-,
点评 本题考查化学平衡计算、胶体制备、元素化合物知识、热化学方程式书写、离子性质和离子浓度大小比较,比较基础,注意对基础知识的理解掌握.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
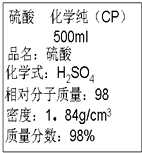
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
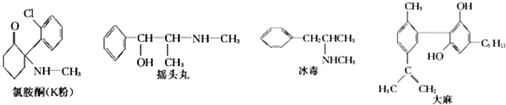
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
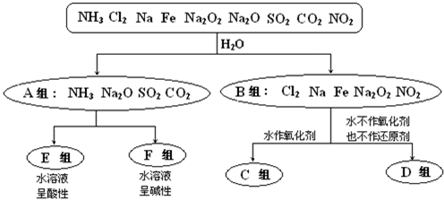
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com