
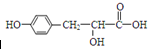
 的说法中,正确的是( )
的说法中,正确的是( )| A. | 在核磁共振氢谱中有五组吸收峰 | |
| B. | 与 互为同分异构体 互为同分异构体 | |
| C. | 1mol 该有机物与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 可以发生取代反应、加成反应、消去反应和缩聚反应 |
分析 A.根据氢原子种类判断核磁共振氢谱吸收峰个数;
B.分子式相同结构不同的有机物互称同分异构体;
C.该物质中能和NaOH反应的有酚羟基、羧基;
D.该物质中含有酚羟基、醇羟基、羧基和苯环,具有酚、醇、羧酸和苯的性质.
解答 解:A.该分子中含有7种氢原子,所以其核磁共振氢谱有7个吸收峰,故A错误;
B. 的不饱和度为5、
的不饱和度为5、 的不饱和度为4,所以二者分子式不同,不是同分异构体,故B错误;
的不饱和度为4,所以二者分子式不同,不是同分异构体,故B错误;
C.该物质中能和NaOH反应的有酚羟基、羧基,所以1mol 该有机物与NaOH溶液反应,最多消耗2mol NaOH,故B错误;
D.该物质中含有酚羟基、醇羟基、羧基和苯环,具有酚、醇、羧酸和苯的性质,醇羟基、酚羟基和羧基都能发生取代反应,苯环能发生加成反应,连接醇羟基碳原子相邻碳原子上含有氢原子,所以能发生消去反应,羧基和羟基发生缩聚反应,故D正确;
故选D..
点评 本题考查有机物结构和性质,涉及同分异构体判断、核磁共振氢谱、官能团及其性质关系等知识点,侧重考查酚、醇、羧酸和苯的性质,注意醇羟基不能和NaOH反应,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
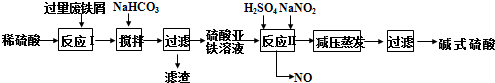
 [Fe2(OH)4]2++2H+.
[Fe2(OH)4]2++2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性的强弱 | |
| B. | 最高价氧化物对应的水化物酸性的强弱 | |
| C. | 单质沸点的高低 | |
| D. | 单质与氢气化合的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
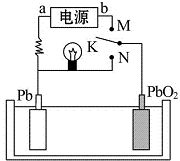
| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为a/2kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| C. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| D. | N2(g)+3H2(g)?2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 石英可用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 清晨阳光穿过林木枝叶铺洒地面属于丁达尔现象 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com