
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=1 135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1 135.7 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=1 135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1 135.7 kJ•mol-1 |
分析 根据盖斯定律来书写,应注意热化学方程式要注明物质的聚集状态和反应热,将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),据此计算出该反应的焓变即可.
解答 解:已知:①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=-534KJ•mol-1
根据盖斯定律,将方程式2×②-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2×(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故选D.
点评 本题考查了盖斯定律的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
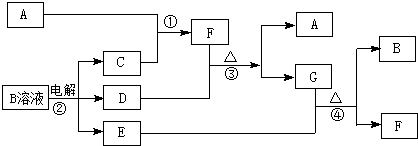
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{118}^{175}$X | B. | ${\;}_{175}^{118}$X | C. | ${\;}_{118}^{293}$X | D. | ${\;}_{293}^{118}$X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
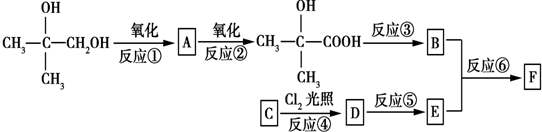
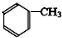 ,反应③的条件是浓硫酸、加热.
,反应③的条件是浓硫酸、加热.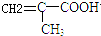 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$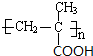 .
.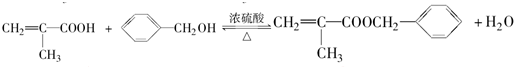 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{10}$ | B. | $\frac{b}{2a+2b}$ | C. | $\frac{3}{16}$ | D. | $\frac{5}{16}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com