
分析 (1)①NH4++HClO═NH2Cl+H++H2O△H=a kJ?mol-1
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ?mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ?mol-1;
(2)①阳极失去电子发生氧化反应;
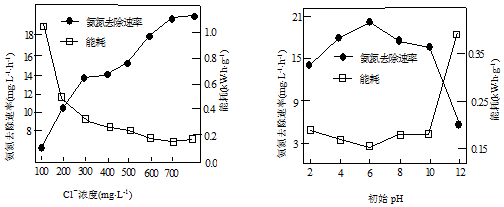
②据4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能来分析;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$;
③据pH太低时,产生的Cl2会从溶液中逸出来分析;
(3)漂白粉的有效成分是Ca(ClO)2,并据题意书写离子方程式;
(4)依据溶度积常数计算不同沉淀下的硫离子浓度.
解答 解:(1))①NH4++HClO═NH2Cl+H++H2O△H=a kJ?mol-1
②2NH2Cl+HClO═N2+H2O+3H++3Cl-△H=b kJ?mol-1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl-△H=(2a+b)kJ?mol-1;
故答案为:2a+b;
(2)①阳极失去电子发生氧化反应,故电极反应方程式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
②氨氮去除速率低而能耗高的原因可能是阳极发生的反应为4OH--4e-=O2↑+H2O,则阳极可能OH-放电,产生大量氧气,消耗电能;当Cl-浓度较高时,测得溶液中的NO3-浓度也较高,可能的原因是:Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$,
故答案为:阳极可能OH-放电,产生大量氧气,消耗电能;Cl-浓度较高时,产生的Cl2(或HClO)较多,会将NH${\;}_{4}^{+}$氧化为NO${\;}_{3}^{-}$;
③当pH过低时,处理效果不佳的原因可能是,pH太低时,产生的Cl2会从溶液中逸出,
故答案为:pH太低时,产生的Cl2会从溶液中逸出;
(3)漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O,
故答案为:2CN-+5ClO-+2OH-+2Ca2+=2CaCO3↓+N2↑+5Cl-+H2O;
(4)Ksp(NiS)=c(Ni+)c(S2-)=1.1×10-21,则c(S2-)=$\frac{Ksp(NiS)}{c(N{i}^{+})}$=$\frac{1.1×1{0}^{-21}}{1.1×1{0}^{-5}}$=10-16mol•L-1,Ksp(CuS)=c(Cu2+)c(S2-)
=1.3×10-36,c(S2-)=$\frac{Ksp(CuS)}{c(C{u}^{2+})}$=$\frac{1.3×1{0}^{-36}}{7.8×1{0}^{-5}}$=1.7×10-32mol•L-1,1.7×10-32mol•L-1<10-16mol•L-1,故则需要控制溶液中S2-的浓度不低于10-16mol•L-1,
故答案为:10-16.
点评 本题考查反应热的计算,电极反应方程式及离子方程式的书写,以及溶度积常数的计算等,本题难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOC3H7 | B. | CH3COOC2H5 | C. | CH3COONa | D. | CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S除去废水中的Hg2+ | B. | 用热的Na2CO3溶液去油污 | ||
| C. | 利用油脂的皂化反应制造肥皂 | D. | 配制CuSO4溶液时加少量稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
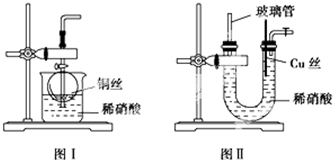
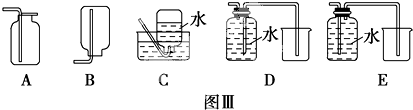
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、SO42-、OH-中的一种或几种离子,取此溶液做下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可知原溶液存在离子为NH4+,其浓度为0.01mol/L | |
| B. | 原溶液一定存在Cl- | |
| C. | 原溶液肯定没有Fe3+、Mg2+,一定含有Na+ | |
| D. | n(NH4+):n(Al3+):n(SO42-)=1:1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
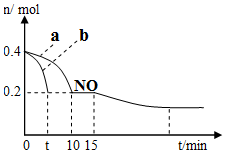 研究发现,NOx和SO2是雾霾的主要成分,已知:
研究发现,NOx和SO2是雾霾的主要成分,已知:| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
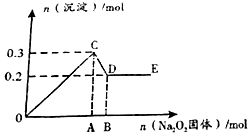
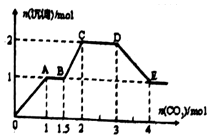 现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,共中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与遇入CO2的量之问的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是Ba2+、Na+、Cl-、NH4+ | |
| B. | 肯定不存在的离子是Cl-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为:0.2mol/L | |
| D. | OA段反应的离子方程式::2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
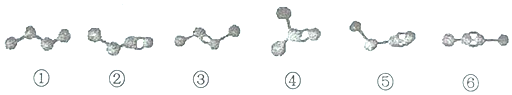
| A. | 烃②、③、④的分子式均为C4H8,三者互为同分异构体 | |
| B. | 烃⑤和⑥的分子式均为C4H6,二者互为同分异构体 | |
| C. | 烃②、③、⑤、⑥分别与足量氧气发生加成反应,均可得到烃① | |
| D. | 等物质的量的烃②和⑤分别在氧气中完全燃烧,烃⑤消耗的氧气多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com