
| A. | 1 molNa2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+离子数为0.1 NA | |
| C. | 理论上氢氧燃料电池负极消耗11.2 L标准状况下气体,外线路通过电子数为NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
分析 A、过氧化钠与水的反应为歧化反应;
B、铁离子为弱碱阳离子,在溶液中会水解;
C、氢氧燃料电池中,负极上放电的是氢气;
D、乙烯和丙烯的最简式均为CH2.
解答 解:A、过氧化钠与水的反应为歧化反应,故1mol过氧化钠转移1mol电子即NA个,故A错误;
B、铁离子为弱碱阳离子,在溶液中会水解,故溶液中含有的阳离子的个数小于0.1NA个,故B错误;
C、氢氧燃料电池中,负极上放电的11.2L气体即0.5mol气体是氢气,根据氢气放电后变为+1价可知,0.5mol氢气放电失去1mol电子,即通过电子数为NA个,故C正确;
D、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,则含2NA个碳原子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 稀释后溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
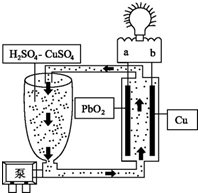 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为正极,b为负极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | b极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
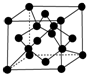 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
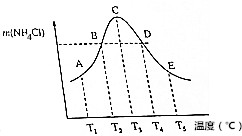 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78g苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com