
| A. | H2SO4溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | 氨水 |
分析 五种溶液含有的阳离子各不相同,但都是氯化物,因而AgNO3溶液不能达到目的,且硫酸与五种氯化物都不反应,主要考查金属氢氧化物的溶解性及颜色.因又涉及到Al3+和Mg2+的鉴别,因此必需选强碱,以此解答该题.
解答 解:A.硫酸和五种氯化物都不反应,不能鉴别,故A错误;
B.AgNO3溶液和五种氯化物都生成沉淀,不能鉴别,故B错误;
C.加入浓NaOH溶液,NaCl无现象,MgCl2生成白色沉淀,AlCl3先生成白色沉淀,沉淀然后溶解,FeCl3生成红褐色沉淀,NH4Cl有刺激性气体生成,现象各不相同,可鉴别,故C正确;
D.加入氨水,不能鉴别氯化钠、氯化铵,也不能鉴别氯化镁和氯化铝,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,侧重于元素化合物知识的综合应用,为高考常见题型,注意把握相关物质的性质,题目难度不大


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
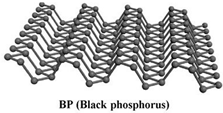 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于高分子化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
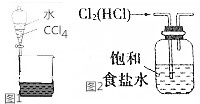 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com