
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.在![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
【答案】B
【解析】
根据所给的信息可知,![]() 溶液中阳离子是
溶液中阳离子是![]() ,且
,且![]() 浓度相同,均为
浓度相同,均为![]() ,而阴离子不同;
,而阴离子不同;![]() 溶液中的阳离子是
溶液中的阳离子是![]() ,且
,且![]() 浓度相同,均为
浓度相同,均为![]() ,而阴离子不同,根据图象可知,
,而阴离子不同,根据图象可知,![]() 的反应速率接近,
的反应速率接近,![]() 的反应速率接近,且
的反应速率接近,且![]() 远大于
远大于![]() ,
,![]() 远大于
远大于![]() ,故阴离子对反应速率影响不大,是阳离子影响了反应速率,据此分析解答。
,故阴离子对反应速率影响不大,是阳离子影响了反应速率,据此分析解答。
A. 根据图象可知,实验装置中的氧气浓度是逐渐降低的,故此腐蚀为吸氧腐蚀,故正极反应均为![]() ,故A正确;
,故A正确;
B. 根据图象可知,![]() 的反应速率接近,
的反应速率接近,![]() 的反应速率接近,且
的反应速率接近,且![]() 远大于
远大于![]() ,
,![]() 远大于
远大于![]() ,故阴离子对反应速率影响不大,
,故阴离子对反应速率影响不大,![]() 是影响反应速率的主要因素,故B错误;
是影响反应速率的主要因素,故B错误;
C.![]() 是影响反应速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,故向实验
是影响反应速率的主要因素,能导致钢铁的吸氧腐蚀速率加快,故向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快,故C正确;
固体,吸氧腐蚀速率加快,故C正确;
D.![]() 溶液显酸性,
溶液显酸性,![]() 显中性,根据图象可知,铁钉的平均腐蚀速率酸性溶液大于中性溶液,故D正确;
显中性,根据图象可知,铁钉的平均腐蚀速率酸性溶液大于中性溶液,故D正确;
故选B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)及其化合物x、y、z有如下转化关系,D与B同主族,下列说法正确的是

A. x、y、z均是离子化合物
B. 简单氢化物的沸点:C﹥B﹥D
C. 最高价氧化物对应的水化物的酸性:A﹥D
D. 简单离子半径:D﹥C﹥B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.  催化剂活性
催化剂活性![]()
B. 
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D.  向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() N2(g)+
N2(g)+![]() H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1;
H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1;
N(g)+3H(g)=NH3(g) ΔH2=-bkJ·mol-1;
NH3(g)=NH3(l) ΔH3=-ckJ·mol-1
试写出N2(g)和H2(g)反应生成液氨的热化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
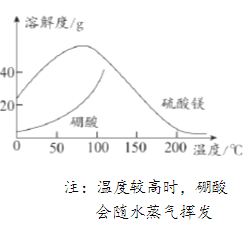
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是
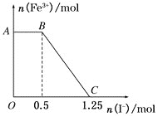
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
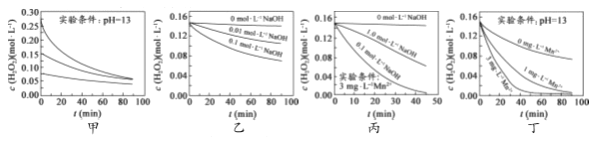
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com