
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| A、+859kJ/mol |
| B、-859kJ/mol |
| C、-1403kJ/mol |
| D、+1403kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).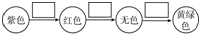
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | - 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.3 mol/L |
| D、N的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.2% | B、30% |
| C、75.5% | D、80.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B、加热分别盛有氯化铵和碘的两支试管,试管底部固体均减少,说明二者均发生升华 |
| C、Fe与稀HNO3溶液、稀H2SO4溶液反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com