
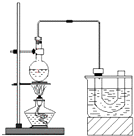
 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:分析 (1)乙醇、浓硫酸和溴化钠加热反应生成溴乙烷、硫酸氢钠和水;
(2)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴;
(3)水浴加热优点:便于控制温度,受热均匀;
(4)U型管得到了溴乙烷;
(5)溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;分液用到分液漏斗;
(6)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解.
解答 解:(1)溴化钠、浓硫酸和乙醇制取溴乙烷的化学方程式为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
故答案为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
(2)由于浓硫酸具有强氧化性,会有溴生成,化学式为Br2,
故答案为:Br2;
(3)依据溴乙烷(沸点为38.4℃),可知温度应控制在38.4℃以下,所以可以使用水浴加热,能够更好的控制温度,且受热均匀;
故答案为:水浴加热;
(4)在U型管内有制取的溴乙烷,所以现象是有油状液体生成,
故答案为:有油状液体生成;
(5)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则
A.溴和溴乙烷都能溶于苯,不能将二者分离,故A错误;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
C.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故C正确;
D.溴乙烷能够溶于四氯化碳,故D错误;
分液使用的主要仪器是分液漏斗,
故答案为:C;分液漏斗;
(6)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.


科目:高中化学 来源: 题型:填空题
 )4种有机物分别在一定条件下与H2充分反应.
)4种有机物分别在一定条件下与H2充分反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀HNO3:3Cu+2NO${\;}_{3}^{-}$+8H+═3Cu2++2NO↑+4H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com