
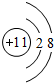 .
.| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
分析 A、B、D、E、G、J六种短周期主族元素,原子半径依次减小,有机化合物均含有E元素,则E为C元素;由元素相对位置,可知G为N元素、B为S元素、D为Cl.A、E、J位于相邻的不同周期,常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子,则A为Na,J为H元素.
(1)A元素离子为Na+,离子核外由2个电子层,各层电子数为2、8;
(2)C2H4与水发生加成反应生成乙醇;
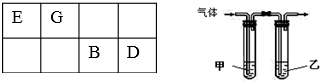
(3)利用单质的相互置换可以证明Cl的非金属性比S的强,甲中应盛放某种弱电解质的溶液,则为硫化氢溶液,通入的气体为氯气,乙中溶液吸收剩余的氯气,防止污染空气,可以盛放氢氧化钠溶液;
(4)D的最高价氧化物为Cl2O7,为无色液体,当0.2mol该物质与一定量的水混合得到一种稀溶液,放出QkJ的热量,该为HClO4溶液,则1molCl2O7(l)反应放出热量为5QkJ,注明物质的聚集状态与反应热书写热化学方程式;
(5)G的最简单氢化物为氨气,溶于水得溶液X为氨水,D的氢化物为HCl.
①溶液浓度相等、体积相等,则恰好反应得到NH4Cl,铵根离子水解溶液呈酸性,溶液中氢离子源于水的电离;
②溶液体积相等,氨水与盐酸的浓度之比为2:1,则混合后为等浓度的NH3.H2O、NH4Cl混合溶液,溶液pH>
7,说明一水合氨的电离程度大于铵根离子的水解程度.
解答 解:A、B、D、E、G、J六种短周期主族元素,原子半径依次减小,有机化合物均含有E元素,则E为C元素;由元素相对位置,可知G为N元素、B为S元素、D为Cl.A、E、J位于相邻的不同周期,常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子,则A为Na,J为H元素.
(1)A元素离子为Na+,离子核外由2个电子层,各层电子数为2、8,离子结构示意图为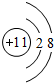 ,
,
故答案为: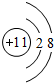 ;
;
(2)C2H4与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,加成反应;
(3)利用单质的相互置换可以证明Cl的非金属性比S的强,甲中应盛放某种弱电解质的溶液,则为硫化氢溶液,通入的气体为氯气,乙中溶液吸收剩余的氯气,防止污染空气,可以盛放氢氧化钠溶液,氯气与氢氧化钠溶液反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:H2S;Cl2+2OH-=Cl-+ClO-+H2O;
(4)D的最高价氧化物为Cl2O7,为无色液体,当0.2mol该物质与一定量的水混合得到一种稀溶液,放出QkJ的热量,该为HClO4溶液,则1molCl2O7(l)反应放出热量为5QkJ,故该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-5QkJ/mol,
故答案为:Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol;
(5)G的最简单氢化物为氨气,溶于水得溶液X为氨水,D的氢化物为HCl.
①溶液浓度相等、体积相等,则恰好反应得到NH4Cl,铵根离子水解溶液呈酸性,溶液中氢离子源于水的电离,则由水电离出的c(H+)=10-5 mol•L-1,
故答案为:10-5;
②溶液体积相等,氨水与盐酸的浓度之比为2:1,则混合后为等浓度的NH3.H2O、NH4Cl混合溶液,溶液pH>
7,说明一水合氨的电离程度大于铵根离子的水解程度,离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查元素推断、实验方案设计、热化学方程式、盐类水解等,题目较为综合,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
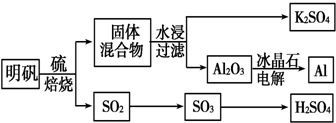
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 次氯酸 | Ka1=2.98×10-8 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
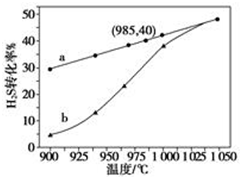 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
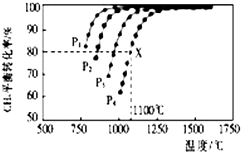 在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.
在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1 mol/L NaOH溶液中加入1mL 0.1mol/LMgCl2溶液,然后再向混合溶液中 滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段 时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀, 加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com