
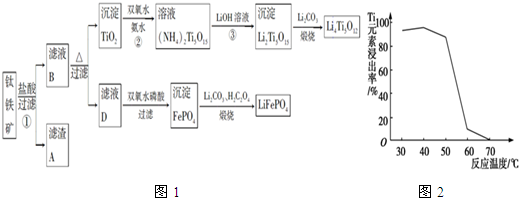
分析 (1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
(5)反应3是(NH4)2Ti5O15与强氧化锂反应生成Li2Ti5O15沉淀和氨水;
(6)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
(7)充电时按照电解槽进行分析,阳极氧化阴极还原,写出阳极放电的电解方程式即可.
解答 解:(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,
故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)根据流程图示可知,反应3是(NH4)2Ti5O15与强氧化锂反应生成Li2Ti5O15沉淀和氨水,反应的化学方程式为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O),
故答案为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O);
(6)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y
34y=90×x×17%,x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9;
(7)充电时,阳极发生氧化反应,LiFePO4失去电子生成FePO4,电极反应为:LiFePO4-e-=FePO4+Li+,
故答案为:LiFePO4-e-=FePO4+Li+.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,考查了化合价判断、离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由正极流向负极 | |
| C. | 在电解池中,物质在阴极发生氧化反应 | |
| D. | 在电解池中,与电源正极相连的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:填空题
I.合成氨的原料气H2可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1  mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述
能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单 位时间内生成amolCO2的同时消耗amolH2
位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.液氨作为一种潜在的清洁汽车燃料已越来越被研究 人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
III.(1)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
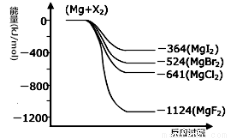
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体(CH4)和沉淀生成。写出CH3MgCl水解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·m
2NH3(g) ΔH=-92.4 kJ·m ol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
ol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
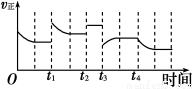
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑨ | B. | ④⑥⑦⑧ | C. | ④⑥⑦⑨ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 抽滤时,滤纸要小于布氏漏斗 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com