
【题目】常温下,向0.1mol·L1二元弱酸H2A的溶液中逐滴加入NaOH溶液,H2A、HA-、A2的物质的量分数随pH的变化如图所示。下列叙述正确的是( )
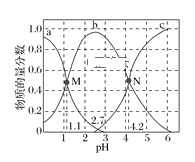
A.a曲线代表HA的物质的量分数随pH的变化
B.M点pH=1.1时,溶液中微粒浓度关系为c(H+)>c(HA)=c(H2A)
C.pH=2.7时,c(A2)+c(HA)+c(H2A)=0.1mol·L1
D.N点pH=4.2时,c(A2)=c(HA),溶液中不存在H2A分子
【答案】B
【解析】
向二元弱酸H2A溶液中逐滴加入NaOH溶液,发生H2A+OH-=HA-+H2O、HA-+OH-=H2O+A2-,然后结合图象以及守恒关系进行分析。
A、向二元弱酸H2A中逐滴加入NaOH溶液,依次发生反应:H2A+OH-=HA-+H2O、HA-+OH-=H2O+A2-,结合题图可知,a曲线代表H2A的物质的量分数随pH的变化,b曲线代表HA-的物质的量分数随pH的变化,c曲线代表A2-的物质的量分数随pH的变化,故A错误;
B、pH=1.1时,溶液中c(H+)=10-1.1mol/L,根据图可知,c(HA-)=c(H2A)<0.05mol·L-1,因此有c(H+)>c(HA-)=c(H2A),故B正确;
C、当pH=2.7时,因滴入NaOH溶液,溶液的体积增大,结合物料守恒可知c(H2A)+c(HA-)+c(A2-)<0.1mol·L-1,故C错误;
D、N点时,c(A2-)=c(HA-),但溶液中仍存在H2A分子,只不过其浓度很小,故D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A.铁屑、溴水、苯混合加热就能制取溴苯
B.用苯、浓硫酸、浓硝酸制取硝基苯时,温度越高反应越快,得到的硝基苯越多
C.乙醇与乙酸混合加热即能发生酯化反应生成有香味的酯
D.![]() 过程中反应①、②分别是取代反应、加成反应
过程中反应①、②分别是取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知![]() ,下列有关叙述错误的是( )
,下列有关叙述错误的是( )

A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,![]()
C.同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
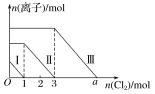
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
)与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH 溶液,然后滴入AgNO3溶液,若有淡黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性FeCl3溶液,若溶液颜色变为紫色,则可证明发生了水解反应。
其中正确的是( )
A.甲B.乙
C.丙D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:

下列说法正确的是( )
A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com