
向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。下列叙述正确的是( )
A.x=10时,溶液中有NH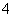 、Al3+、SO
、Al3+、SO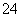 ,且c(NH
,且c(NH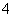 )>c(Al3+)
)>c(Al3+)
B.x=10时,溶液中有NH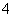 、AlO
、AlO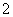 、SO
、SO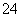 ,且c(NH
,且c(NH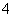 )>c(SO
)>c(SO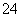 )
)
C.x=30时,溶液中有Ba2+、AlO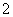 、OH-,且c(OH-)<c(AlO
、OH-,且c(OH-)<c(AlO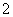 )
)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
解析 10 mL 0.1 mol·L-1 NH4Al(SO4)2的溶液中,加入等浓度Ba(OH)2溶液时,Ba2+与SO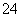 反应,OH-与NH
反应,OH-与NH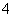 、Al3+反应。当x=10时,NH4Al(SO4)2与Ba(OH)2物质的量相等,Ba2+、OH-反应完毕,SO
、Al3+反应。当x=10时,NH4Al(SO4)2与Ba(OH)2物质的量相等,Ba2+、OH-反应完毕,SO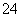 剩一半没有反应,由于Al3+结合OH-的能力大于NH
剩一半没有反应,由于Al3+结合OH-的能力大于NH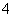 ,故OH-优先与Al3+反应,根据Al3++3OH-===Al(OH)3↓可知OH-不足,Al3+未完全反应,NH
,故OH-优先与Al3+反应,根据Al3++3OH-===Al(OH)3↓可知OH-不足,Al3+未完全反应,NH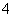 没有与OH-反应,所以溶液中有NH
没有与OH-反应,所以溶液中有NH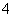 、Al3+、SO
、Al3+、SO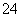 ,且c(NH
,且c(NH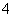 )>c(Al3+),由于NH
)>c(Al3+),由于NH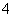 水解导致溶液中c(SO
水解导致溶液中c(SO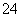 )>c(NH
)>c(NH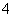 ),故A项正确,B项错误。当x=30时,Al3+转化为AlO
),故A项正确,B项错误。当x=30时,Al3+转化为AlO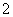 ,NH
,NH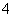 转化为NH3·H2O。由于NH3·H2O的电离导致反应后溶液中c(OH-)大于c(Ba2+)和c(AlO
转化为NH3·H2O。由于NH3·H2O的电离导致反应后溶液中c(OH-)大于c(Ba2+)和c(AlO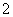 ),故C、D项错误。
),故C、D项错误。
答案 A


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有____________________________。
(2)已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________________。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:
___________________________________________
___________________________________________。
(4)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当结合NNR′OHO或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol某烃与1.5 mol过量氧气混合,充分燃烧后,将生成物全部通过足量的Na2O2固体,固体增重23.4 g。从Na2O2中逸出标准状况下24.64 L气体。
(1)求该烃的分子式。
(2)又知该烃能使KMnO4酸性溶液褪色,但不能使溴水因反应褪色,写出该烃可能的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3
下列各项排序正确的是( )
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④
D.c(CH3COOH):①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数为________________。
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合。
(1)若所得混合液为中性,且a=2,b=12,则VaVb=________。
(2)若所得混合液的pH=10,且a=2,b=12,则VaVb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件的变化是因为降低活化能,增加单位体积内反应物分子中活化分子的百分数而使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
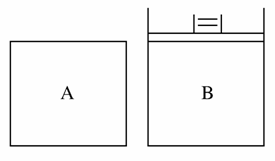
有A、B两容器(如图所示),A容积固定,B容积可变。一定温度下,在A中加2 mol N2、3 mol H2,发生反应:N2+3H22NH3,达平衡时生成NH3的物质的量为n。
(1)相同温度下,在B中充入4 mol N2、6 mol H2,当B的压强与A的压强相等,B中反应达平衡时,生成NH3的物质的量________2n(填“>”“<”或“=”,下同);当B的容积与A的容积相等,B中反应达平衡时,生成NH3的物质的量________2n。
(2)相同温度下,保持B的容积为A的一半,并加入1 mol NH3,要使B中反应达平衡时各物质的浓度分别与上述A容器中平衡时相同,则起始时应加入________mol N2和________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):

(1)A的类别是________,能与Cl2反应生成A的烷烃是________。B中的官能团是________。
(2)反应③的化学方程式为______________________。
(3)已知:B 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液, 能除去的副产物是________。

则经反应路线②得到的一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为________。
(5)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生, 则L与NaOH的乙醇溶液共热,所得有机物的结构简式为__________________________________________________。(任写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com