
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ�����һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ����
��1����֪�� CH3OH��g��=HCHO��g��+H2��g����H=+84kJ/mol
2H2��g��+O2��g��=2H2O��g����H=��484kJ/mol
�ٹ�ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH��g����O2��g����Ӧ����HCHO��g����H2O��g�����Ȼ�ѧ����ʽ�� ��
���������Ʊ���ȩʱ������Ӧ����ͨ���ʵ���������������Ŀ���� ��
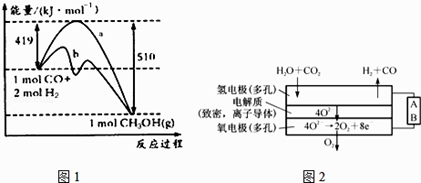
��2����ҵ�Ͽ������·����ϳɼ�ȩ����ѧ����ʽΪCO��g��+2H2��g��=CH3OH��g������֪ijЩ��ѧ���ļ����������±���
��ѧ�� | C��C | C��H | H��H | C��O | C��O | O��H |
����/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
��ش��������⣺
����ͼ������a������b�Ĵ�ʩ�� ��
����֪CO�е�C��O֮��Ϊ�����������ΪxkJ/mol����x=
��3���ɼ״���������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε磮 �ٸõ�������ĵ缫��ӦʽΪ ��
�����Ըõ��Ϊ��Դ����ʯī���缫���200mL�����������ӵ���Һ��
���� | Cu2+ | H+ | Cl�� | SO42�� |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
���һ��ʱ��������ռ�����ͬ�������ͬ�����£�������ʱ��������Һ����ı仯���缫������ܴ��ڵ���Һ�����������ռ�������������Ϊ ��
��4�����ˮ������CO2�����ϳ�����H2+CO�����ϸ��¶��£�700��1000�棩����SOEC����缫��ʩ��һ����ֱ����ѹ��H2O��CO2����缫������ԭ��Ӧ����O2�� �� O2���������ܵĹ������������ʲ㵽�����缫�������缫����������Ӧ�õ���O2 �� ����ͼ��֪AΪֱ����Դ�����������������������д����H2OΪԭ������H2�ĵ缫��Ӧʽ�� ��
���𰸡�
��1��2CH3OH��g��+O2��g��=2HCHO��g��+2H2O��g����H=��316kJ?mol��1����״���ת����
��2�����������1097
��3��O2+2H2O��4e��=4OH����3.2g
��4��������H2O+2e��=H2��+O2��
���������⣺��1������֪����CH3OH��g��=HCHO��g��+H2��g����H=+84kJ/mol����2H2��g��+O2��g��=2H2O��g����H=��484kJ/mol����2����+�ڵõ�CH3OH��g����O2��g����Ӧ����HCHO��g����H2O��g�����Ȼ�ѧ����ʽΪ2CH3OH��g��+O2��g��=2HCHO��g��+2H2O��g����H=��316 kJmol��1 �� ���Դ��ǣ�2CH3OH��g��+O2��g��=2HCHO��g��+2H2O��g����H=��316 kJmol��1��������Ӧ��Ũ�ȣ���ʹƽ�������ƶ�����״���ת���ʣ����Դ��ǣ���״���ת���ʣ���2��������a������b����ܽ��ͣ�ӦΪ������������Դ��ǣ������������CO��g��+2H2��g��CH3OH ��g�����ʱ�=��Ӧ���ܼ���֮�ͩ��������ܼ���֮�ͣ���CO��̼�����ļ���ΪX�����ͼ���ṩ�Ļ�ѧ���ļ��ܣ����H�TX+2��436KJ/mol����3��413KJ/mol+358KJ/mol+463KJ/mol��=��419��510��kJmol��1=��91kJmol��1 �� ��ã�X=1097KJ/mol��
���Դ��ǣ�1097����3���٢�ȼ�ϵ�أ���ص�һ���缫ͨ ���������һ���缫ͨ��״����壬�����������������Һ������ԭ���ԭ���������缫��Ӧ��O2�õ�����������������������O2+2H2O+4e��=4OH�� ��
���Դ��ǣ�O2+2H2O��4e��=4OH��������������ʾͭ���ӵõ��ӣ�Cu2++2e��=Cu��200mL0.5mol/L��ͭ���ӵõ������ʵ�����0.2mol��Ȼ����2H++2e��=H2��������������0.4mol������ʧ���ӵķ�Ӧ����������0.2mol��2Cl����2e��=Cl2����ת�Ƶ�����0.4mol��Ȼ��������������ʧ���Ӳ���������4OH����4e��=O2��+2H2O���������ռ�����ͬ�������ͬ������������ʱ������������������ʵ�����x���������ϲ��������ǣ�0.2+x��mol�����ݵ����غ㣬�õ�0.4+4x=0.2+2��0.2+x�������x=0.1mol�����������ռ�������������Ϊ3.2 g��
���Դ��ǣ�3.2 g����4����ͼʾ��֪A��ˮ��������̼����������CO��Ӧ������ԭ��Ӧ��Ϊ������Ӧ����AΪ��Դ�ĸ��������������ķ�ӦΪH2O+2e��=H2��+O2�� ��
���Դ��ǣ�������H2O+2e��=H2��+O2�� ��
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ���֪A��B��E 3��ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��CԪ�ص������������ȴ�����������4��DԪ��ԭ�Ӵ�����������������������3��
��1��A�ڿ�����ȼ������ԭ�Ӹ�����Ϊ1:1�Ļ����д�������ʽΪ_______��д��EԪ�ص�ͬ�������Ԫ�صĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ______________��
��2��д��D��E��Ԫ������������Ӧˮ���������ǿ��_________���û�ѧʽ��ʾ����
��.��������ѩ�ֺ�ʱ����ʹ��һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1 mol XY2����54 mol���ӡ�
��1������ѩ��XY2���γɹ�����________________��XԪ�������ڱ���λ����_______��
��2��Ԫ��Q��Wԭ�ӵ�����������������Ӳ�����2����Q��Y���ڣ���Q�����ӽṹʾ��ͼ��_______��Q��W���γ�һ�ֽṹ������CO2����ԭ�ӷ��ӣ���ÿ��ԭ�Ӿ��ﵽ��8e���ȶ��ṹ���÷��ӵĵ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�ܵ����ijЩ�л���ĸ��ܣ��������һ���г�������ζ���ж����壬��������ǣ� ��
A.COB.CH4C.H2SD.SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��H2O���ںܶѧ��Ӧ�о��м�����Ҫ�����ã����о�����ˮ�����������ԭ��Ӧ��
��NaH+H2O�TNaOH+H2��
��2Na2O2+2H2O�T4NaOH+O2��
��Na+2H2O�T2NaOH+H2��
��3NO2+H2O�T2HNO3+NO
��2H2O ![]() 2H2��+O2��
2H2��+O2��
��2F2+2H2O�T4HF+O2
ˮֻ��������������ˮֻ����ԭ��������ˮ������������������ԭ��������ˮ�Ȳ������������ֲ��ǻ�ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���Ϊ10L�������У�ͨ��һ������CO��H2O��g������850��ʱ�������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����CO��H2O��g��Ũ�ȱ仯��ͼ 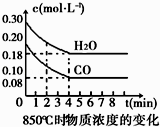
��1��0��4min��ƽ����Ӧ����v��CO��=molL��1min��1 ��
��2���������£��˷�Ӧ��ƽ�ⳣ��K=��д����ʽ����
��3���÷�Ӧƽ��ʱCO��ת����Ϊ ��
��4�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� �� A��������ѹǿ���� B�����������c��CO������
C��v��H2����=v��H2O���� D��c��CO2��=c��CO��
�������¶ȣ��÷�Ӧ��Kֵ�� �� �÷�Ӧ�Ļ�ѧ��Ӧ���ʽ����������С�����䡱����
��5��t�棨����850�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯�����
ʱ�䣨min�� | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��c1��ֵ0.08molL��1������ڡ�С�ڻ���ڣ���
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ���� �� ����5min��6min֮����ֵ�����仯�����ܵ�ԭ���� ��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������������ȷ���ǣ� ��

A. ��Ӧ�Ļ�ѧ����ʽΪX(g)+Y(g) = 2Z(g)
B. ��Ӧ��ʼ��10 s����Z��ʾ�ķ�Ӧ����Ϊ0��079 mol��L-1��s-1
C. ��Ӧ���е�3 sʱ��v(X)��v(Z)
D. �ﵽ��Ӧ��ʱ��Y��ת����Ϊ21%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ����м���2.0 mol SO2��1.0 mol O2��һ�������·������·�Ӧ2SO2��O2![]() 2SO3����Ӧ�ﵽƽ������ʵ����ʵ�������Ϊ(����)
2SO3����Ӧ�ﵽƽ������ʵ����ʵ�������Ϊ(����)
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 0.20 | 0.10 | 1.80 |
C | 1.0 | 0.8 | 1.0 |
D | 0 | 0 | 2.0 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ����������������֪A��Bԭ�Ӿ�����ͬ�ĵ��Ӳ�������AԪ�ص��������������ۺ�Ϊ�㣬C��ͬ������ԭ�Ӱ뾶����Ԫ�أ�D��ͬ���������Ӱ뾶��С��Ԫ�ء�C�ĵ����ڼ�����������B�ĵ��ʳ�ַ�Ӧ�����Եõ���E������ɫ��ͬ�ĵ���ɫ��̬������F���Ը������������ش�
��1��DԪ�������ڱ���λ��Ϊ_____________________��
��2������E�����ӽṹʾ��ͼ_____________��д��ABE���ӵĽṹʽ____________��
��3����ҵ�ϳ���������������A������EB2��Ӧ�����������Ļ������⣬д���û�ѧ����ʽ��___________________________________________��
��4���õ���ʽ��ʾC2E���γɹ���__________________________________________��
��5��1 mol F��AԪ�ص���������ﷴӦʱת�Ƶĵ�����Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��L��MΪ�˵�������������ǰ20������Ԫ�ء�X2����������壬Y��L��M����Ԫ�ص���������Ϊ5�ı������ش��������⣺
��1��X��L��ɵ��������ĵ���ʽΪ��
��2��X��M��ɵ�����Ϊ������ۡ������ӡ�������������ʿ���ΪҰ�����Ӧ��ȼ�ϣ�����ˮ��Ӧ�Ļ�ѧ����ʽΪ��
��3��Y�����ڱ��е�λ���� �� �京����Ļ�ѧʽΪ��
��4��L��M�γɵĻ�������L�Ļ��ϼ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com