
| A. | 乙酸可以做调味剂 | B. | 油脂可用来制造肥皂 | ||
| C. | 乙烯可用作水果催熟剂 | D. | 工业酒精可用于勾兑白酒 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 从海水中可以得到 NaCl,电解饱和 NaCl 溶液可制备 Na | |
| B. | 锅炉水垢中含有的 CaSO4,可先用 Na2CO3溶液处理,后用酸除去 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的单质硅 | |
| D. | 钢铁器件镀金既能增加美观,又能在镀层局部破损后防止器件损耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
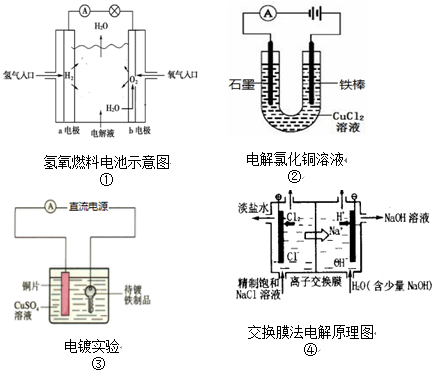
| A. | 装置①中,b极发生氧化反应 | |
| B. | 装置②中,铁棒上析出红色固体 | |
| C. | 装置③中,若电镀前两极金属的质量相等,电镀完成后二者质量差5.12g,则电镀时电路中的待镀铁制品应与电源负极相连,外电路转移的电子数为0.08mol | |
| D. | 装置④中,离子交换膜应为阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W>Y | B. | 简单离子的半径:W>X | ||
| C. | 阴离子的还原性:Z<W | D. | Y与Z能形成离子化合物Y2Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
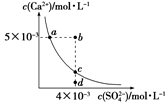 常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 | |
| B. | a点对应的Ksp等于c点对应的Ksp | |
| C. | d点溶液通过蒸发可以变到c点 | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 褪色但无沉淀 | B. | 不褪色但有沉淀 | ||
| C. | 褪色且有沉淀 | D. | 不褪色也没有沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com