
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图为一用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图。请认真读图,回答以下问题:
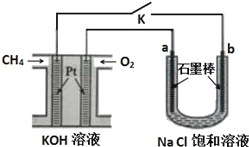
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值___(填“不变”或“变大”或“变小”)
(2)如果通入1mol的甲烷完全参与电极反应,则电路中转移_____________的电子,a电极产生的气体在标准状况下的体积为_________________。
【答案】 CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O 变小 8mol 89.6L
【解析】试题分析:本题考查甲烷燃料电池的工作原理和电极反应式的书写,多池串联的计算。
(1)通入甲烷的一极为负极,由于电解质溶液为KOH溶液,CH4在负极被氧化成CO32-,电极反应式为CH4-8e-+10OH-=CO32-+7H2O。由于消耗OH-,c(OH-)减小,其附近的pH变小。
(2)根据电极反应式,1mol甲烷参与反应,电路中转移8mol电子。a极与甲烷燃料电池的正极相连,a极为阳极,a极电极反应为2Cl--2e-=Cl2↑,电路中转移8mol电子,a极生成的Cl2物质的量为4mol,在标准状况下的体积为4mol![]() 22.4L/mol=89.6L。
22.4L/mol=89.6L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度时,测得0.01 mol/L的NaOH溶液的pH为11,在此温度下,将pH=12的强碱与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比为( )
A. 1∶9 B. 9∶1 C. 1∶11 D. 11∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4Na+3CO2==2Na2CO3+C,下列说法正确的是
A. Na是氧化剂 B. Na在反应中被氧化
C. CO2 全部被还原 D. CO2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲醛易挥发,甲酸钙易溶于水。为探究过量的甲醛和新制Cu(OH)2反应的产物,进行如下实验:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5mol·L-1NaOH 溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热20分钟后冷却至室温。

仪器a、b的名称分别是________________、_______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A 和如下图所示装置连接后进行实验。

依次连接的合理顺序为A→____→____→____→____→____→G。副产物中如果有CO,实验现象是:_____________________________________。
(3)已知HCHO 最终被氧化为CO32-,请写出a容器中发生的反应化学方程式:_________________________________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O 假设二:只有Cu
假设三:CuO和Cu 假设四:_______________;
其中假设三明显不成立,理由是___________________________________。
(5)为了对(4)的猜想进行验证,进行如下实验(以下任步均充分反应):
已知:已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色)
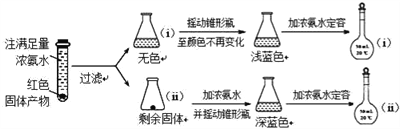
①锥形瓶ii中固体加入浓氨水后,完全溶解得到深蓝色溶液,该过程所发生的离子方程式为 __________________________________________;
②将容量瓶ii中的溶液稀释20倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Cu2+、Cl-D.Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com