
(1)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(2)标准状况下有① 6.72 L CH4 ② 3.01×1023个HCl ③ 13.6 g H2S ④ 0.2 mol NH3四种气体,气体所占体积由小到大的顺序是(填序号,下同) ;所含氢原子数由小到大的顺序是 。
(3)已知某植物营养液配方为0.3 mol KCl,0.2 mol K2SO4,0.1 mol ZnSO4和1 L水。若以KCl,K2SO4,ZnCl2和1 L水为原料配得相同组成的营养液,需三种溶质KCl mol,K2SO4 mol,ZnCl2 mol。
科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:填空题
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾,溴,镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高一12月化学卷(解析版) 题型:填空题
(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净 水剂,其原理是_______________(用离子方程式表示)。
水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
过量的NaHCO3和Na2O2混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是
A.Na2O B. Na2CO3 C.Na2O2和Na2CO3 D.Na2O2和Na2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
下列事实或现象与胶体性质无关的是
A.向三氯化铁溶液中加入NaOH溶液出现红褐色沉淀
B.煮沸的 FeCl3溶液冷却后,用一束光照射,有一条光亮的通路
C.胶态金属氧化物分散于玻璃中制成有色玻璃
D.明矾溶于水可以用来净水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)在稀硫酸与锌反应制取氢气的实验中,探究加入硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0~4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336mL)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是
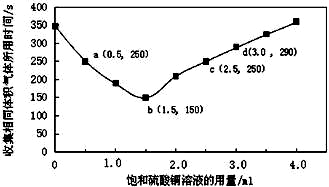
A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a、c两点对应的氢气生成速率相等
C.b点对应的反应速率为v(H2SO4) = 1.0×10-3 mol·L-1·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高二上12月月考化学卷(解析版) 题型:选择题
用2-丁炔为原料制取CH3CHBrCBrClCH3,可行的反应途径是
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
在一定条件下,向体积为2L的密闭容器中加入2 mol N2和10 mol H2发生如下反应:
N2+3H2 2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是( )
2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是( )
A、v(N2)=0.25mol·L-1·min-1 B、v(H2)=0.0125 mol·L-1·s-1
C、v(NH3)=1.0 mol·L-1·min-1 D、v(H2)=0.75 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com