
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
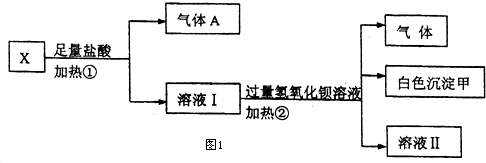
分析 Ⅰ.无色溶液,判断Fe3+不存在,加过量盐酸生成气体和溶液,判断溶液中一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,白色沉淀甲是硫酸钡;
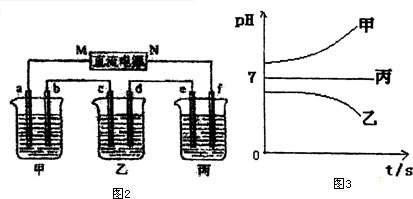
Ⅱ.测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为电源负极,则b为阳极,碱溶液中OH-放电;
(2)e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
(3)乙烧杯中为惰性电极电解硫酸铜溶液;
(4)B溶液中的金属离子全部析出,电解质为硫酸,能电解;
(5)丙中电解质为硫酸钠或硫酸钾,实质为电解水.
解答 解:Ⅰ.无色溶液,判断Fe3+不存在,加过量盐酸生成气体和溶液,判断溶液中一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,一定有铵根离子,白色沉淀甲是硫酸钡,原溶液一定含有硫酸根.
(1)白色沉淀甲是硫酸钡,故答案为:BaSO4;
(2)碳酸钠溶液与过量稀盐酸混合完全反应生成CO2,反应的离子方程式为CO32-+2H+=H2O+CO2↑,铵盐能与碱反应生成氨气:NH+4+OH-=NH3↑+H2O,故答案为:CO32-+2H+=H2O+CO2↑;NH+4+OH-=NH3↑+H2O;
(3)X溶液中一定存在的离子是NH+4、CO32-、SO2-4,一定不存在的离子是Fe3+、Ba2+、Al3+,尚未确定是否存在的离子是K+,故答案为:NH+4、CO32-、SO2-4;K+;
Ⅱ.测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为电源负极,则b为阳极,碱溶液中OH-放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:负;4OH--4e-=O2↑+2H2O;
(2)e电极上氢离子放电生成氢气,n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(3)乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)B溶液中的金属离子全部析出,电解质为硫酸,电解时溶液中的氢离子、氢氧根离子放电,能继续电解,
故答案为:能;因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应;
(5)丙中电解质为硫酸钠或硫酸钾,实质为电解水,由电子守恒可知H2O~2e-~Cu,则要恢复原状,加0.25mol×18g/mol=4.5g水,故答案为:加入4.5g水.
点评 本题考查了离子检验的方法应用、电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.


科目:高中化学 来源: 题型:解答题
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
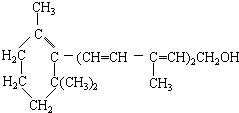
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取| 元 素 | X | Y | Z |
| 电 负 性 | 1.5 | 1.2 | 1.8 |
| 第一电离能/kJ•mol-1 | 578 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com