
 、
、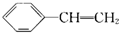 、
、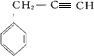 .
. 科目:高中化学 来源: 题型:填空题
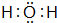 ,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;
,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 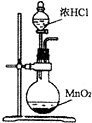 用装置制取氯气 | |
| B. | 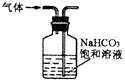 用装置除去CO2中的少量SO2气体 | |
| C. | 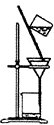 用装置分离回收H2 02制氧气中的二氧化锰 | |
| D. | 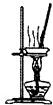 用装置将MgCl2.6H2O加热得到MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
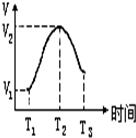 把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.
把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
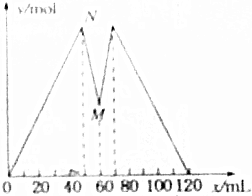 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )| A. | N点时溶液中的溶质只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol/L | B. | 0.6mol/L | C. | 0.75mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠是一种优良的净水剂 | |
| B. | 锅炉用水的软化可以用阳离子交换法 | |
| C. | 聚氯乙烯塑料薄膜可用于制食品包装袋 | |
| D. | 若镀层被破坏镀锡的铁皮不如镀锌的铁皮耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 放热反应都不需要加热就可以发生 | |
| C. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| D. | 化学反应放热还是吸热,取决于反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com