
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态 Fe原子有_______个未成对电子,Fe3+的电子排布式为 _____,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度___________g·cm-3(不必计算出结果)。
【答案】X—射线衍射 4 1s22s22p63s23p63d5 血红色 sp3、sp2 乙酸存在分子间氢键 16 12 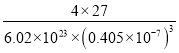
【解析】
(1)区分晶体、准晶体和非晶体的方法是X—射线衍射;
(2)根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;乙酸分子间可形成氢键导致沸点较高;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占![]() ,通过一个顶点可形成8个晶胞;根据ρ=
,通过一个顶点可形成8个晶胞;根据ρ=![]() 计算密度。
计算密度。
(1)从外观无法区分三者,区分晶体、准晶体和非晶体的方法是X—射线衍射,
故答案为:X—射线衍射;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,Fe失去3个电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色;
(3)乙醛中甲基上的C形成4个σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3个σ键和1个π键,无孤电子对,采取sp2杂化类型;乙酸分子间可形成氢键,乙醛分子间不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
故答案为:sp3、sp2;乙酸存在分子间氢键;16;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占![]() ,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×
,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×![]() =12;一个晶胞中Al原子数为8×
=12;一个晶胞中Al原子数为8×![]() +6×
+6×![]() =4,因此Al的密度ρ=
=4,因此Al的密度ρ=![]() =
=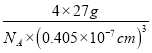 =
=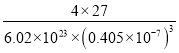 gcm-3,
gcm-3,
故答案为:12;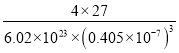 。
。


科目:高中化学 来源: 题型:
【题目】为探究X(仅含三种元素)的组成和热稳定性,设计并完成如下实验:
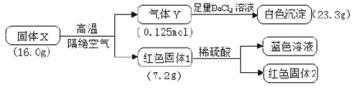
气体Y不能使品红溶液褪色,红色固体1是一种纯净物,请回答:
(1)X除了含有Cu元素之外,还有___元素(填元素符号)。
(2)该流程中X高温分解的化学方程式为____。
(3)写出气体Y通入BaCl2溶液发生反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________。
(2)写出氮气分子的结构式_____________。
(3)①CaBr2②H2O③NH4Cl④H2O2⑤HClO⑥I2,只含有离子键的是(用序号回答,下同)_____________,含有共价键的离子化合物是_____________,含有非极性共价键的共价化合物是_____________,常温时为固体,当其熔化时,不破坏化学键的是_____________。
(4)在①![]() Li、②
Li、②![]() N、③
N、③![]() Li、④
Li、④![]() C几种核素中:
C几种核素中:
①_____________和_____________(填序号,下同)互为同位素。
②_____________和_____________的质量数相等,但不能互称同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为:__________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
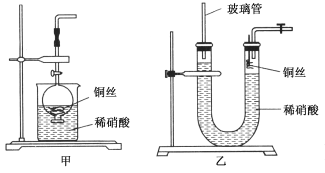
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填选项代号)。

(5)假设实验中12.8gCu全部溶解,需要通入标况下________LO2才能使NO全部溶于水。
(6)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是____________________________。
甲:铜+浓硝酸→硝酸铜
乙:铜+稀硝酸→硝酸铜
丙:铜+氯气→氯化铜;氯化铜+硝酸→硝酸铜
丁:铜+空气→氧化铜;氧化铜+硝酸→硝酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
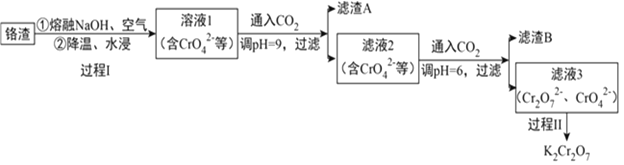
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质可以循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
Cr2O72-+H2O K=4.0×1014滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。下表是不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 373 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:向滤液③中加入稀盐酸和KCl固体后,_____________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
Fe2O3(s)+![]() CO(g)===
CO(g)===![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ·mol-1
CO2(g) ΔH=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=640.4 kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. -218 kJ·mol-1B. -109 kJ·mol-1
C. 218 kJ·mol-1D. 109 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
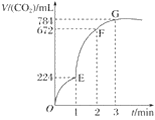
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. G点表示收集的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO![]() >HCO
>HCO![]() ,某无色溶液Y中可能含有以下几种离子:Cl-、SO
,某无色溶液Y中可能含有以下几种离子:Cl-、SO![]() 、HCO
、HCO![]() 、HSO
、HSO![]() 、Fe3+、Ba2+、NH
、Fe3+、Ba2+、NH![]() 、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
、Na+,溶液中阳离子浓度相同,为了确定其组成,某课题小组进行如下实验(假设气体均全部逸出、忽略H2O2的分解)
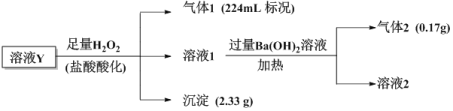
下列说法不正确的是
A.溶液1中一定不存在Fe3+、SO![]()
B.气体1为CO2气体
C.溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D.溶液Y中可能存在Na+,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种新型消毒剂的结构式,其中,Y、Z、W处于不同短周期、不同主族,X、W的简单离子核外电子排布相同,X的最外层电子数恰好等于Y、Z、W的最外层电子数之和,下列说法中正确的是( )

A.在元素周期表中,Y 位于 IVA 族
B.原子序数大小关系: Z > W > X > Y
C.W 元素被称为“国防金属”
D.电解熔融的氯化钠可得到 Z 的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com