
| A. | Cu→CuSO4 | B. | C→CO2 | C. | CuO→CuSO4 | D. | Fe2O3→Fe2(SO4)3 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
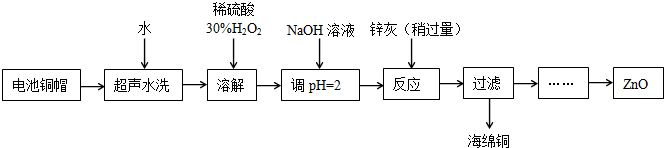
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )| A. | 该氨水的浓度0.1000mol•L-1 | |
| B. | 点①溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-) | |
| C. | 点②溶液中c(NH4+)=c(Cl-) | |
| D. | 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭和浓硫酸共热 | B. | 过氧化钠与足量的稀硫酸反应 | ||
| C. | 足量的铜与一定量的浓硝酸反应 | D. | 足量的锌和定量的浓硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
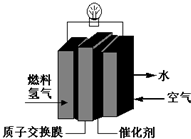
| A. | 总反应式为:O2+2H2═2H2O | |
| B. | 正极的电极反应式为:O2+4H+═2H2O+4e- | |
| C. | 通入氧气的电极发生氧化反应 | |
| D. | 通入氢气的电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

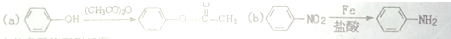
 ,F含有的官能团是羧基和酚羟基(填名称).
,F含有的官能团是羧基和酚羟基(填名称). .
.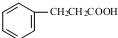 .
.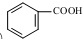 发生取代时,在羧基间位取代;②
发生取代时,在羧基间位取代;② 易发生氧化反应.以A为原料合成化合物
易发生氧化反应.以A为原料合成化合物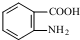 的设计合成路线为(其他试剂任选):
的设计合成路线为(其他试剂任选):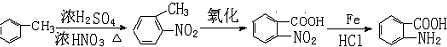 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com