
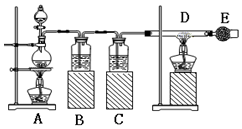
 已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:
已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:分析 由制取无水氯化铁的实验装置图可知,A中发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B中饱和食盐水除去HCl,C中浓硫酸干燥氯气,在D中发生Fe+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$FeCl3,E中碱石灰可吸收尾气,且防止空气中的水进入D中,防止氯化铁水解,据此分析解答.
解答 解:(1)烧瓶中发生反应的化学方程式是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢,所以B中盛放的饱和食盐水;氯化铁易水解,故C为干燥氯气的试剂浓硫酸;
故答案为:饱和食盐水,浓硫酸;
(3)玻璃管D中反应生成氯化铁,化学反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)干燥管E中盛有碱石灰(CaO+NaOH),除吸收未反应的氯气外,还有一个作用是防止空气中的水进入D中;
故答案为:吸收氯气或防止空气中水蒸气进入.
点评 本题考查氯化铁的制备,为高频考点,把握发生的反应、实验装置的作用、实验原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金一定是多种金属的混合物 | B. | 合金的性能往往比纯金属优越 | ||
| C. | 合金的熔点一般比其组成金属低 | D. | 合金的硬度一般比其组成金属大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③⑤⑦ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质活泼性:C2>B2>A2 | B. | 还原性:A->B->C- | ||
| C. | 氧化性:A2>B2>C2 | D. | 反应:A2+2C-=2A-+C2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:Na+、HCO3-、NO3-、SiO32- | |
| B. | 某透明溶液中:Fe3+、K+、NO3-、Cl- | |
| C. | 某溶液中加入金属铝有氢气放出:K+、Ba2+、Cl-、SiO32- | |
| D. | 某无色溶液中:K+、Al3+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com