
下图表示的是往某![]() 溶液中滴入稀盐酸产生的过程。
溶液中滴入稀盐酸产生的过程。
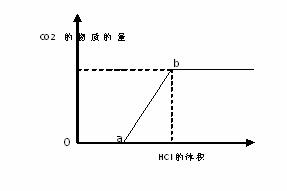
(1)写出![]() 点以前发生反应的离子方程式 。
点以前发生反应的离子方程式 。
(2)写出![]() 点到
点到![]() 点发生反应的离子方程式 。
点发生反应的离子方程式 。
(3)若某![]() 溶液中含
溶液中含![]()
![]()
![]() ,向其中滴入一定量的稀盐酸,恰好使溶液中
,向其中滴入一定量的稀盐酸,恰好使溶液中![]() 和
和![]() 的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
的物质的量之比为2:1,则滴入稀盐酸的物质的量等于 ![]() (用
(用![]() 表示)。
表示)。
科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源:辽宁省沈阳二中2010-2011学年高一10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
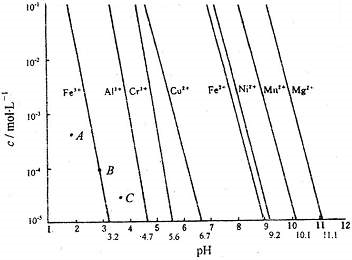
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) |
|
|
|
|
|
|
|
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) |
|
|
|
|
|
|
|
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com