
| A. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| B. | 28g N2中含有的分子数为NA | |
| C. | 1mol Mg与足量稀盐酸反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 Na2 CO3溶液中含有的钠离子数为NA |
分析 A、标况下水为液态;
B、求出氮气的物质的量,然后根据分子个数N=nNA来分析;
C、镁反应后变为+2价;
D、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子来分析.
解答 解:A.标准状况下,22.4L H2O是液体,不能根据气体摩尔体积来计算其物质的量,故A错误;
B.28g N2的物质的量为1mol,故含有的分子数为NA,故B正确;
C.1mol Mg与足量稀盐酸反应后变为+2价,故转移的电子数为2NA,故C错误;
D.1L 1mol•L-1 Na2 CO3溶液中含有的碳酸钠的物质的量为1mol,而1mol碳酸钠中含2mol钠离子即2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
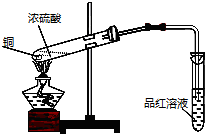
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
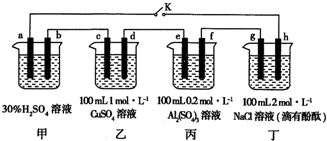
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰-Ca(OH)2 | B. | 小苏打-KHCO3 | C. | 重晶石-CaSO4 | D. | 醋酸-C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 101mL | C. | 119mL | D. | 120mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com