
| A、m1=m2 |
| B、混合物A中CaCO3和KHCO3质量比一定为1:1 |
| C、25m1=21m2 |
| D、混合物B中MgCO3和NaHCO3质量比可为任意比 |
| m1 |
| 100 |
| w |
| 44 |
| m2 |
| 84 |
| w |
| 44 |


科目:高中化学 来源: 题型:
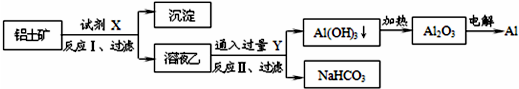
| A、试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C、结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
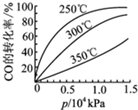
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁过程中发生的主要反应为
高炉炼铁过程中发生的主要反应为| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往待测液中滴加氯水,然后滴加KSCN溶液,以检测待测液中是否含有Fe2+ |
| B、往待测液中滴加BaCl2,然后滴加盐酸,以检测待测液中是否含有SO42- |
| C、蒸馏操作时应将温度计的水银球插入液面下 |
| D、向试管中加入5mL SO2水溶液,然后滴加BaCl2溶液,再滴加3%的H2O2溶液,以检测SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、装修新房季节最好选择夏季 |
| B、适度开窗通风,充分地进行内外空气对流 |
| C、用高浓度的甲醛对室内环境消毒 |
| D、在各个房间内均匀的放置适量的吊兰、芦荟等鲜花 |
查看答案和解析>>
科目:高中化学 来源: 题型:
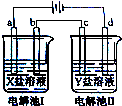 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | CuSO4 |
| C. | FeSO4 | Al2(SO4)3 |
| D. | CuSO4 | AgNO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
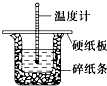 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com