
【题目】分子式为C5H6Br2的有机物,其结构不可能是( )
A.只含有一个双键的直链有机物
B.含两个双键的直链有机物
C.含一个双键的环状有机物
D.含一个三键的直链有机物
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置如下:

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/ g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。

将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18 g。回答下列问题:
(1)装置B的名称是___________,装置C的作用是____________________。
(2)配制混合液时,________(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:____________________________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是____________。
(4)在洗涤操作中,第二次水洗的作用是_____________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140 ℃,应选用空气冷凝管,不选用直形冷凝管的原因是________________________________。
(6)本实验所得到的硝基苯产率是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
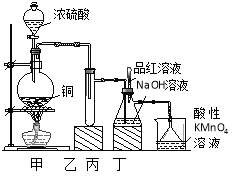
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
步骤3: | 若 则 ; 否则 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人认为在元素周期表中位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A. NaH B. H3O+ C. HF D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。其制取原理为: Al2O3+3C+N2![]() 2 AlN+3CO
2 AlN+3CO
为了分析某AlN样品中 AlN的含量,某化学研究性学习小组成员设计了如下两种实验方案。
【方案1——量气法】用图中的一些装置来进行相关实验,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。

(1)图中仪器A的名称是 _______;写出AlN和NaOH溶液反应的化学方程式________。
(2)广口瓶中的试剂X最好选用下列试剂中的_______(填选项的标号),广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将________(填“偏大”、 “偏小”或“不变”)。
A.苯 B.酒精 C.植物油 D.CCl4
(3)若实验中测得样品的质量为2.56g,氨气的体积为1.12L(标况下),则样品中AlN的质量分数为______。
【方案2——测重量】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为_______________。
(5)步骤③的操作是_____________。
(6)A1N的纯度是______________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 19.2g SO2在标准状况下的体积为___________L,其中含氧原子的物质的量为_______mol,该气体在标准状况下的密度是______________。
(2)0.5mol H3PO4的质量是_______g,含______个H3PO4分子,含______mol氧原子
(3)在标准状况下,将_______L NH3溶于水得到0.5 mol·L-1的氨水500 mL;配制100 mL 0.1 mol·L-1CuSO4溶液,需要CuSO4·5H2O________g。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________;
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.Na2O、Na2O2与CO2反应产物相同
D.SiO2是酸性氧化物,能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生成锂离子电池。下列说法正确的是
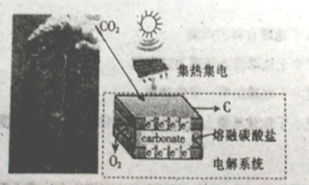
A. 图中能量转化方式只有一种
B. 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑
C. 若反应中转移1mole-,则理论上消耗CO32-0.5mol
D. 当生成12g碳材料时,可收集到22.4LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com