
【题目】把铝、铁混合物 1.1g 溶于200mL 5molL ﹣1盐酸中,反应后盐酸的浓度变为4.6molL ﹣1(溶液体积变化忽略不计).求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
【答案】
(1)解:消耗HCl的物质的量为0.2L×5molL﹣1﹣0.2L×4.6molL﹣1=0.08mol,
答:反应中消耗HCl的物质的量为0.08mol;
(2)解:设Al、Fe的物质的量分别为x、y
由2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑
则
Al | ~ | 3HCl |
x | 3x |
Fe | ~ | 2HCl |
y | 2y |
![]() ,
,
解得x=0.02mol、y=0.01mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.01mol.
【解析】(1)利用n=cV,根据反应前HCl的物质的量减去反应后溶液中HCl的物质的量来计算;(2)根据金属的质量之和为1.1g及反应中消耗的HCl来列式计算即可.


科目:高中化学 来源: 题型:
【题目】常温下,下列各组粒子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O72﹣、K+、SO42﹣
B.NaHCO3溶液中: ![]() 、CO32﹣、Br﹣、K+
、CO32﹣、Br﹣、K+
C.加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl﹣、NO3﹣
D.C(Ca2+)=0.1 molL﹣1的溶液中:NH4+、SiO32﹣、CH3COO﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。
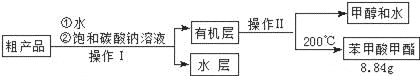
(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
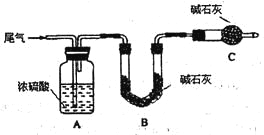
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应为:Pb(s)+SO![]() (aq)-2e-===PbSO4(s)
(aq)-2e-===PbSO4(s)
B. 充电时电能转化为化学能
C. 放电时,电解液的密度增大
D. 充电时,电解液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com