
【题目】 下列说法正确的是( )
A. 在标准状况下,1 mol水的体积是22.4 L
B. 1 mol H2所占的体积约为22.4 L
C. 在标准状况下, 阿伏加德罗常数个分子所占的体积约为22.4 L
D. 在标准状况下,1 mol NH3和CO混合气体所占的体积约为22.4 L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
(3)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH碱性强于NH3H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由. .
(4)Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律 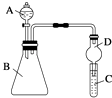
仪器B的名称为 , 干燥管D的作用为 .
(5)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液(填现象),即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为2L的密闭容器中发生反应:2HI(g)H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)实验1和实验2中使用了催化剂的实验是(填“1”或“2”);
(2)实验1中,0l0min内生成H2的平均反应速率为molL﹣1min﹣1;
(3)实验3的反应达到化学反应限度时,HI(g)转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)D、E、F 的离子半径由大到小的顺序为_________(填离子符号)。
(2)写出能证明G比F非金属性强的一个离子方程式_____________。
(3)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为_______,该反应的化学方程式为___________________。
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为_______。常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QkJ,该反应的热化学方程式为_____________________。
(5)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L 氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。

按照实验步骤依次回答下列问题:
(1)导线中电流方向为__________________(用a、b表示)。
(2)原电池的正极为___________
(3)写出装置中铜电极上的电极反应式:____________________________________;
(4)若装置中铜电极的质量增加32 g,则导线中转移的电子数目为________;
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向______(填“左侧”或“右侧”)烧杯移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有毒气体的减排和处理是工业生产中的重要课题。
(1)Na2CO3溶液可吸收尾气SO2,反应过程中溶液组成变化如下图。

①SO2分子属于________ (选填“极性”或“非极性”) 分子,以上反应_____(选填“能”或“不能”) 说明S、C两种元素的非金属性强弱。
②A点反应的离子方程式是_____。
(2)汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

①已知Ba(NO3)2分解产物含有两种气体,由上图信息,写出Ba(NO3)2分解反应的化学方程式_______。
②下列说法正确的是__________
A.稀燃过程的目的是固氮
B.在整个过程中,Pt和BaO都可看作催化剂
C.汽车尾气若不处理,其中的氮氧化物等可能形成光化学烟雾
D.富燃过程中,NO2与CO反应,氧化产物和还原产物的物质的量之比为1:1
③实验测出,每千克CxHy (以液体C8H18为例) 在O2中充分燃烧生成液态水,放出4.78×104kJ热量。写出C8H18燃烧热的热化学反应方程式______________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+ H2O =2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______%。
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=5 :3时,可通入一定量的空气,同温同压下,V(空气): V(NO)=___________ (空气中氧气的体积含量大约为20%)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2O(l)===H2(g)+![]() O2(g)ΔH=+285.8 kJ/mol
O2(g)ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)===H2O(g)ΔH=-241.8 kJ/mol
O2(g)===H2O(g)ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol
④C(s)+![]() O2(g)===CO(g)ΔH=-110.5 kJ/mol
O2(g)===CO(g)ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时________(填“吸收”或“放出”)热量,△H______0(填“>”或“<”)
(2)上述反应中属于吸热反应的是____________
(3)C的燃烧热为________;H2燃烧生成气态水的热值为_______ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,对下列事故或药品的处理正确的是( )
A. 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场
B. 金属钠着火燃烧时,用泡沫灭火器灭火
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D. 含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com