
| A. | N2比O2的化学性质稳定 | B. | F2、Cl2、Br2、I2的沸点逐渐升高 | ||
| C. | 金刚石的熔点比晶体硅高 | D. | HF、HCl、HBr、HI的热稳定性依减弱 |
分析 A.氮气的键能大于氧气的键能;
B.相对分子质量越大,物质的沸点越高;
C.原子半径越大,键长越大,键能越小,熔点越低;
D.元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定.
解答 解:A.氮气的键能大于氧气的键能,所以N2比O2的化学性质稳定,与共价键有关,故A不选;
B.相对分子质量越大,分子间作用力越大,物质的沸点越高,所以F2、C12、Br2、I2的沸点逐渐升高,与共价键无关,故B选;
C.金刚石、晶体硅都属于原子晶体,金刚石中碳碳键的键长小于晶体硅中硅硅键的键长,所以金刚石的硬度、熔点、沸点都高于晶体硅,与共价键有关,故C不选;
D.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与共价键有关,故D不选;
故选B.
点评 本题考查晶体的熔沸点的比较以及化学键知识,侧重于学生的分析能力和基础知识的综合运用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 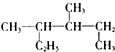 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 樱桃中含有一种羟基酸(如图所示)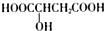 ,该羟基酸可以发生取代、氧化和缩聚等反应 ,该羟基酸可以发生取代、氧化和缩聚等反应 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中2个碳原子都是sp2杂化 | B. | 乙烯分子存在非极性键 | ||
| C. | 乙烯分子中4个H原子在同一平面上 | D. | 乙烯分子有6个σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
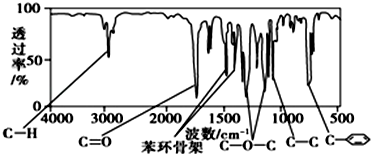
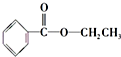 、
、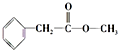 ;
;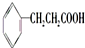 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
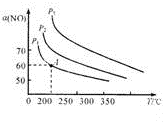 | 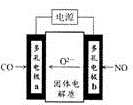 | 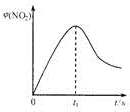 |
| 图1 | 图2 | 图3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com