
���� ��1��������c=$\frac{1000��w%}{M}$�������ʵ���Ũ�ȣ�������ɫ��Ӧ������������Ƿ���ڣ�
��2�����ݷ���ʽ��ϲ��������㣻
��3���������Ĺ���Na2O2��ͨ��12.4gCO2��H2O��������Ӧ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2������������6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=12.4g-6g=6.4g������n��O2��=$\frac{6.4g}{32g/mol}$=0.2mol����������CO2��ˮ���������ʵ����ֱ�ΪΪxmol��ymol�������������������ʵ�������������֮�ͣ��з��̼��㣮
��� �⣺��1��������ˮ�����ʵ���Ũ��c=$\frac{1000��w%}{M}$=$\frac{1000��1g/cm3��0.9%}{58.5g/mol}$=0.15mol/L�������ӵļ��鷽�����ýྻ�IJ�˿պ������Ʒ���ڻ��������գ�ͨ����ɫ�ܲ��������������ɫ����˵���м��Σ�
�ʴ�Ϊ��0.15mol/L���ýྻ�IJ�˿պ������Ʒ���ڻ��������գ�ͨ����ɫ�ܲ��������������ɫ����˵���м��Σ�
��2����������̼�����Ƶ�����Ϊx����
2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O ��������
168 62
x 7g-6.38g=0.62g
x=1.68g��
����̼���Ƶ�����Ϊ7g-1.68g=5.32g��
��ԭ������д��������������$\frac{5.32g}{7g}$��100%=76%��
�ʴ�Ϊ��76%��
��3�����������Ĺ���Na2O2��ͨ��12.4gCO2��H2O������ֻ����6g������Ϊ����O2�����������غ㶨�ɿ�֪m��O2��=12.4g-6g=6.4g������n��O2��=0.2mol��V��O2��=0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��4.48L��
����������CO2��ˮ���������ʵ����ֱ�Ϊxmol��ymol����
2Na2O2+2CO2=2Na2CO3+O2��
x 0.5x
2Na2O2+2H2O=4NaOH+O2��
ymol 0.5ymol
����0.5x+0.5y=0.2��44x+18y=12.4
��ã�x=0.2mol��y=0.2mol
ԭ��������ж�����̼������Ϊ��0.2mol��44g/mol=8.8g��
�ʴ�Ϊ��8.8 g��
���� ���⿼��������йؼ��㡢�������Ƶ����ʵȣ�ע��������������仯��ԭ���ݷ�Ӧ�ķ���ʽ���㣬�Ѷ��еȣ������ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �Ȼ������Ʊ����߷��ӻ����������л��ϳ����й㷺����;�����������գ�
�Ȼ������Ʊ����߷��ӻ����������л��ϳ����й㷺����;�����������գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2O+O2+4e-=4OH- | B�� | Fe-2e-=Fe2+ | ||
| C�� | 2H++2e-=H2�� | D�� | Fe-3e-=Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
| Al2O3 | Na2O2 | Si | Na2SiO3 |
| ���������� | ���������� | ���� | ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ��OH-�����ʵ���Ũ�� | B�� | ��Һ�ĵ������� | ||
| C�� | ��Һ�е�$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$ | D�� | CH3COOH�ĵ���̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �ƺ�ˮ��Ӧ��2Na+2H2O=2Na++2OH-+H2�� | |
| B�� | ����������������Һ��Ӧ��H++OH-=H2O | |
| C�� | ���Ȼ�����ʴӡˢ��·�壺Fe3++Cu=Fe2++Cu2+ | |
| D�� | ������������������Һ��Ӧ��2Al+2OH-=2AlO2-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
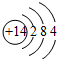 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
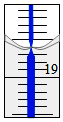
| A�� | ��25 mL��Ͳ��ȡ4.0 mol/L������5.62 mL | |
| B�� | ���������ʱ������ˮ�������½��ϳ� | |
| C�� | ���ܽ⡢���ˡ������ķ��������Ȼ���������صĻ���� | |
| D�� | �����������յ�����CuSO4•5H2O���õ�CuSO4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com