
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
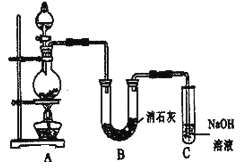
(1)A、B中的反应物分别是浓盐酸和MnO2。写出所发生的化学方程式__________,进入装置C的气体中所含杂质是_____、_____。
(2)漂白粉的有效成分是____(填化学式);D中所发生的化学反应的离子方程式是_______。
(3)此实验所得漂白粉的Ca(ClO)2产率偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是__。②为避免另一副反应的发生,应采取的措施是________。
(4)若将该实验中残留的Cl2,缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:________,若将KI改为KBr溶液,则溶液变为__色,未检测到HBrO3的存在。由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是______。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O HCl H2O Ca(ClO)2 Cl2+2OH-=Cl-+ClO-+H2O 将U型管置于冷水浴中 在B、C之间连接一个盛有饱和食盐水的洗气瓶 5Cl2+I2+12H2O=2HIO3+10HCl 橙 HBrO3>Cl2>HIO3
MnCl2+Cl2↑+2H2O HCl H2O Ca(ClO)2 Cl2+2OH-=Cl-+ClO-+H2O 将U型管置于冷水浴中 在B、C之间连接一个盛有饱和食盐水的洗气瓶 5Cl2+I2+12H2O=2HIO3+10HCl 橙 HBrO3>Cl2>HIO3
【解析】
(1)浓盐酸与二氧化锰在加热的条件下生成氯气、二氯化锰和水;浓盐酸具有挥发性,生成的氯气中含有水蒸气、HCl等杂质;
(2)漂白粉的主要成分为氯化钙、次氯酸钙,有效成分为次氯酸钙;氯气与消石灰反应生成氯化钙、次氯酸钙和水;
(3)①减少副反应的进行,可使U型管在冷水浴中进行反应;②防止HCl与消石灰反应,可在A、B之间加一个盛有饱和食盐水的洗气瓶;
(4)已知溶液变无色时,生成的产物为HIO3,则氯气与碘、水反应生成氯化氢、碘酸;而氯气与溴化钾反应时,只生成溴和氯化钾,无溴酸生成。
(1)浓盐酸与二氧化锰在加热的条件下生成氯气、二氯化锰和水,方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,生成的氯气中含有水蒸气、HCl等杂质,消石灰也为潮湿的,则杂质进入装置C中;
MnCl2+Cl2↑+2H2O;浓盐酸具有挥发性,生成的氯气中含有水蒸气、HCl等杂质,消石灰也为潮湿的,则杂质进入装置C中;
(2)漂白粉的主要成分为氯化钙、次氯酸钙,有效成分为次氯酸钙;氯气与消石灰反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(3)①减少副反应的进行,可使U型管在冷水浴中进行反应;②防止HCl与消石灰反应,可在A、B之间加一个盛有饱和食盐水的洗气瓶;
(4)已知溶液变无色时,生成的产物为HIO3,则氯气与碘、水反应生成氯化氢、碘酸,化学方程式为5Cl2+I2+12H2O=2HIO3+10HCl;而氯气与溴化钾反应时,只生成溴和氯化钾,无溴酸生成,溶液呈棕色,说明溴酸的氧化性大于氯气,氯气的氧化性大于碘酸。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)写出以上反应的化学方程式:______________________________________________
(2)根据上表中的实验数据,可以得到的结论是______________________________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4) = ___________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是____________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _____ | t |
③若该小组同学提出的假设成立,应观察到的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,

(1)如图所示的物质分类方法名称是___。
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑧、⑩后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②__ | ③NaOH ④___ | ⑤Na2SO4 ⑥___ | ⑦SO2 ⑧__ | ⑨NH3 ⑩__ |
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为:___。
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于___盐(填正盐、酸式盐或碱式盐)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用![]() 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:

(1)A、B、C三种物质可以归为一类的依据是_______________________________。
(2)将C归为化合物,将D归为单质的理由是_______________________________。
(3)用化学反应方程式表示为________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
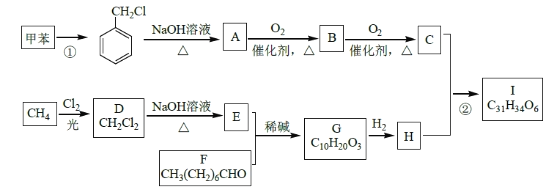

回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_____________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。
①遇FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:![]() )____________。
)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有NOx,容易形成酸雨污染环境,可通过多种化学方法对烟气进行脱硝处理。回答下列问题:
(1)在无氧条件下,脱硝反应为:6NO(g)+4NH3(g)5N2(g)+6H2O(g)△H=-1807.0kJmol-1,T℃时,在恒容的密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
时间/min | 0 | 1 | 2 | 3 | 4 |
n(NO)/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
①下列说法正确的是______(填序号)。
A.3min后NO和NH3的浓度都不再变化,反应停止进行
B.前2min内的平均反应速率v(N2)=0.20molL-1min-1
C.达到平衡时NO的转化率为50%
D.及时分离出N2,可使该反应的反应速率增大,平衡正向移动
②若反应开始的压强为p0,则该反应的化学平衡常数Kp=______(可用分数表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)在有氧条件下,NOx也能发生脱硝反应。
①已知:N2(g)+O2(g)=2NO(g)△H=180.6kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
H2O(g)=H2(g)+![]() O2(g)△H=241.8kJmol-1
O2(g)△H=241.8kJmol-1
则脱硝反应4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)△H=______kJmol-1
②臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g)△H<0,反应在恒容密闭容器中进行,NO2的百分含量随压强(p)、x的变化如图所示:
则p1______p2(填“>”“<”或“=”),x表示的物理量除时间外,还可能是______。
(3)利用惰性电极电解也能对烟气进行脱硝处理。电解原理如图所示:

电极a的电极反应式为______,当电解44.8L(标准状况)含5%NO的烟气,理论上电路中通过电子的物质的量为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com