
| A. | 第一电离能:④>②>③>① | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:④>③>①>② | D. | 最高正化合价:④>③>②>① |
分析 由核外电子排布式可知,①1s22s1为Li元素,②1s22s2为Be元素,③1s22s22p1 为B元素,④1s22s22p5为F元素,
A.同周期随原子序数增大,元素的第一电离能呈增大趋势,但Be元素原子2s能级为全满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.同周期自左而右电负性增大,同主族自上而下电负性减小;
D.最高正化合价等于最外层电子数,注意F、O元素一般没有正化合价.
解答 解:由核外电子排布式可知,①1s22s1为Li元素,②1s22s2为Be元素,③1s22s22p1 为B元素,④1s22s22p5为F元素,
A.同周期随原子序数增大,元素的第一电离能呈增大趋势,但Be元素原子2s能级为全满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱,故第一电离能F>Be>B>Li,即④>②>③>①,故①正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Li>Be>B>F,即①>②>③>④,故B错误;
C.同周期自左而右电负性增大,则电负性:④>③>②>①,故C错误;
D.Li元素最高正化合价为+1,Be元素最高正化合价为+2,B最高正化合价为+3,F没有最高正化合价,故D错误;
故选A.
点评 本题考查核外电子排布规律、元素周期律等知识,难度不大,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素,为易错点,试题有利于提高学生的灵活应用能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 苯与液溴在催化剂作用下生成溴苯 | |
| C. | 乙烯与氢气在催化剂作用下生成乙烷 | |
| D. | 乙醇在铜催化、加热条件下与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
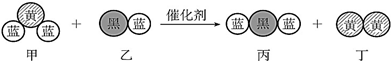 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )| A. | 甲、乙、丙、丁中有3 种非极性分子 | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | H2CO3、HNO3的相对强弱与分子中键的极性相关 | |
| D. | N2O5的水化物中不存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氧化铝获得铝 | B. | 戴维发现金属钠 | ||
| C. | 青铜器时代 | D. | 锌铸币的出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe与稀硝酸:Fe+2HNO3→Fe2++H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeS固体放人稀硫酸溶液中:FeS+2H+→Fe2++H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com