
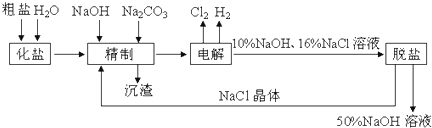
分析 (1)电解氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧化钠;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,杂质离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;
(3)粗盐中含大量Ca2+、Mg2+、SO42-,为有效除去这些离子,选NaOH除去镁离子,碳酸钠除去钙离子、氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后,可除去过量的钡离子;
(4)经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升.当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl,获得的NaCl可循环使用,据此进行解答.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,杂质离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以Ca2+、Mg2+除杂过程中涉及的离子方程式为:Ca2++CO32-═CaCO3↓;Mg2++2OH-═Mg(OH)2↓,故答案为:Ca2++CO32-═CaCO3↓;Mg2++2OH-═Mg(OH)2↓;
(3)粗盐中含大量Ca2+、Mg2+、SO42-,为有效除去这些离子,选NaOH除去镁离子,碳酸钠除去钙离子、氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后,可除去过量的钡离子,bc均符合,故答案为:bc;
(4)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、冷却、结晶、过滤;
故答案为:过滤.
点评 本题考查混合物分离提纯的综合应用及海水资源利用等,为高频考点,把握分离流程中的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | N-N | N-H | O=O | N≡N |
| 键能kJ•mol-1 | 3a | 2.5a | 4a | 8a |
| A. | 2a kJ•mol-1 | B. | 2.5a kJ•mol-1 | C. | 3a kJ•mol-1 | D. | 3.5a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
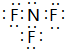 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com