
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
分析 A.根据Ksp(CH3COOAg)=c(CH3COO-)×c(Ag+)计算;
B.根据Ksp(AgCl)以及Ksp(Ag2CrO4)计算生成沉淀时银离子的浓度,根据银离子浓度判断;
C.根据Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-)计算;
D.Ksp(AgCl)只受温度的影响.
解答 解:A.等体积混合浓度均为0.1mol•L-1,c(CH3COO-)×c(Ag+)=0.01>2.3×10-3,一定产生CH3COOAg沉淀,故A正确;
B.0.001 mol•L-1的KCl溶液中形成AgCl沉淀时,银离子的浓度为c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.001}$=1.8×10-7mol/L,0.001 mol•L-1的K2CrO4溶液中形成Ag2CrO4沉淀时,c(Ag+)=$\sqrt{\frac{1.9×1{0}^{-12}}{0.001}}$=$\sqrt{19}$×10-5mol/L,则KCl溶液中形成AgCl沉淀时银离子浓度小,即AgCl先达到饱和,应先生成AgCl沉淀,故B错误;
C.Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-),c(OH-)≥$\sqrt{\frac{1.1×1{0}^{-11}}{0.11}}$=10-5 mol•L-1,溶液的pH至少要控制在9以上,故C正确;
D.Ksp(AgCl)只受温度的影响,与浓度无关,所以在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变,故D正确;
故选B.
点评 本题综合考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握计算公式的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
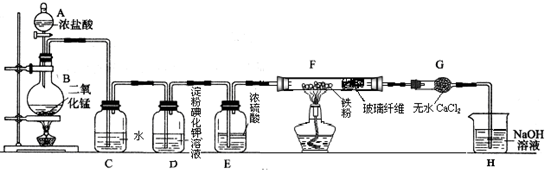
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火炬燃料丙烷充分燃烧后只生成二氧化碳和水 | |
| B. | 撑杆跳高运动员使用的碳纤维撑杆属于有机高分子材料 | |
| C. | 泳池中加入的适量漂白粉可起到杀菌消毒作用 | |
| D. | 举重和体操运动员手上涂抹的碳酸镁白色粉末可吸水防滑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
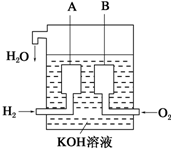 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
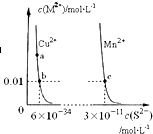
| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com