
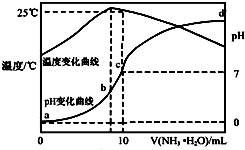
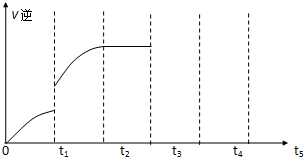
 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a点Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
分析 A.水的电离是吸热反应,降低温度抑制水电离,导致其离子积常数降低;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,且温度越高水的电离程度越大;
C.c点溶液呈中性,氯化铵溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,c点酸碱体积相等,则氨水浓度大于1.0mol/L,b点溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
D.25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
解答 解:A.水的离子积与温度有关,温度越低水的离子积常数越小,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH未知,则无法判断a、d两点水的电离程度大小,故B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=$\frac{0.5(n-1)×1{0}^{-7}}{0.5}$=(n-1)×10-7,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查分析计算判断能力,明确温度与水电离程度关系、溶液中溶质成分及其性质、水解平衡常数表达式是解本题关键,难点是D中水解平衡常数的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2中氧元素的化合价是-2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 16S的结构示意图: | D. | 甲烷的结构式为: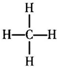 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
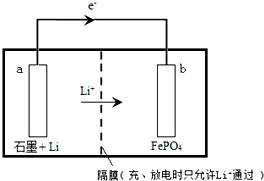 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
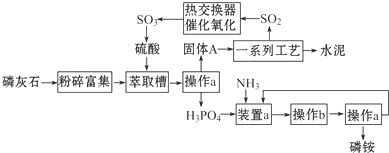
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
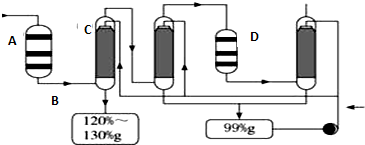
 X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U是第四周期11列元素.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
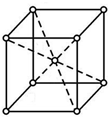 X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1.
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1. ;W元素的名称为镍.
;W元素的名称为镍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性 | |
| C. | 采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com