
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO -152℃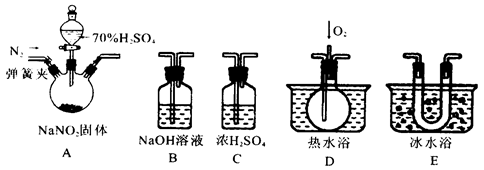
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
(1)E D B(2分);检验装置的气密性(1分) (2)①D中出现红棕色气体(2分) ②冷凝,使NO2完全液(2分)(3)4NO2+O2+4NaOH=4NaNO3+2H2O(2分) 水会与NO2反应产生NO,影响NO的确定(2 分)
(4)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O(2分)
(5) CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1(2分)
解析试题分析:本题是实验题。实验题是同学们的难点。也是最难得分的题型。对于实验题,首先需看清楚实验目的是什么。在结合看清实验流程,实验操作,物质检验等知识会穿插其中。这题是一道实验探究题,探究NaNO2与H2SO4的反应。从所给装置中,A显然是发生装置。B是NaOH溶液,可能是除杂装置,C是浓硫酸,显然是干燥装置。D是热水浴,并通入了O2,需要通O2检验的是NO气体。E是冷水浴装置。显然是冷却物质。由题中所给2个信息,第一个信息是NO与NO2的混合气体与NaOH发生归中反应。第二个信息是NO、NO2两种气体的物理性质。从液化的温度来看,显然NO2比NO更易液化。A中三颈瓶,采用固液不加热反应,还有一个弹簧夹用来控制通氮气,显然要氮气,目的应是排除氧气。因氧气有氧化性。可能会对实验结果产生干扰。通过上述信息就可以猜测出产生的两种气体可能是NO和NO2。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):
A是发生装置,C是干燥除去水,NO和NO2的分离,先分离NO2因为更易液化。所以接E,NO2分离后再检验NO,需通氧气。接D。观察到气体从无色变成红棕色。所以说明是NO。B是尾气处理。吸收反应后剩余的NO和NO2的混合气体。在这里存在几个先后问题,首先NO和NO2的检验,根据液化温度判断得到NO2更易液化,可以观察到E中有红棕色液体产生。而后NO会和氧气生成NO2。对于NO2的检验会产生干扰。所以先检验NO2。还有一问题就是除水,如果不除去水的话,NO2会与H2O反应生成NO,所以又会对NO的检验产生干扰,同时也影响NO2的检验。还有一问题就是在A中药品反应之前需通氮气将O2排出来。否则也会影响NO和NO2的检验。装置连接好之后,就是检查装置气密性。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。说明生成了NO2气体。
①确认A中产生气体含有NO,是在D装置中通O2来检验的。观察气体是否变红棕色。
②装置E的作用是冷凝,是使NO2完全液化。
(3)如果向D中通入过量O2,不存在NO剩余,但有过量的O2会与NO2发生氧化还原反应,O2降低,NO2升高,所以可推断出反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。如不干燥,水会与NO2反应产生NO,影响NO的确定。
(4)通过上述实验探究过程,可得出装置A中反应应产生两种气体。+3价氮元素发生歧化反应。化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
根据盖斯定律上式×2-下式可得出:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1(2分)
考点:探究实验及实验评价


科目:高中化学 来源: 题型:填空题
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校学生化学实验小组,为验证非金属元素氟的氧化性强于硫和氮,设计了一套实验装置:(部分加持装置已略去)
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,反应的化学方程式为 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例) 。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。
请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化铜是一种黑色粉末,其制品除在烟花中使用外还可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂。为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源回收再利用,减少污染。
(1)获得硫酸铜
该小组同学利用H2O2和H2SO4混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜。
写出该反应的化学方程式 。
(2)制备氧化铜
①步骤I的目的是除去可溶性杂质;
②步骤II的目的是得到CuSO4·5H2O固体。该步骤操作是 、 、过滤、水浴加热烘干。水浴加热的特点是 。
(3)探究氧化铜是否能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表: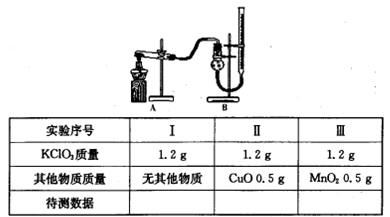
回答下列问题:
①上述实验中的“待测数据”指 。
②若要证明实验II中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞, 。
③为探究CuO在实验III中是否起催化作用,需补做如下实验(无需写出具体操作):
a.CuO的化学性质有没有改变;b 。.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)证明反应所产生的气体中有SO2生成的现象是 。
(2)证明气体中含有氢气的实验现象是 。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 | | |
| 步骤②:往b试管中滴入 。 | | 溶液含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式: __________________________ 、
_________________________________ 。
(2)根据甲同学设计的实验及现象不能证明是乙炔与溴发生了加成反应,其理由是 _______
(a)使溴水褪色的反应,未必是加成反应 (b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的离子方程式是 ;在验证过程中必须全部除去。
(4)为验证此反应是加成而不是取代,丙同学用pH试纸来测试反应后溶液的酸性,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学是一门实用的、中心的学科,生活中的许多问题常涉及到化学知识。它在给经济发展和群众生活带来方便的同时,也产生负面的影响。下列有关叙述不正确的是
| A.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量 |
| B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等。电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害,所以废旧电池必须回收再利用 |
| C.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌。自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
| D.明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆”,所以明矾不宜大量作净水剂使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com