
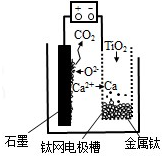
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A. | 将熔融CaF2-CaO 换成Ca 处理也可以达到相同目的 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb 电极 |
分析 根据图知,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2$\frac{\underline{\;一定条件下\;}}{\;}$Ti+2CaO,“+”接线柱应连接原电池正极.
解答 解:A.将熔融CaF2-CaO换成Ca(NO3)2溶液时,阴极上氢离子放电,所以得不到钙,故A错误;
B.阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为2Ca2++4e-═2Ca,故B正确;
C.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2 $\frac{\underline{\;一定条件下\;}}{\;}$Ti+2CaO,所以CaO质量不变,故C错误;
D.“+”表示原电池正极,所以“+”接线柱应连接原电池正极,故D错误;
故选B.
点评 本题考查了电解原理,根据图片知微粒变化确定阴阳极及两个电极上发生的反应,难点是电极反应式的书写,注意该过程中有氧离子参加反应,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cu2+、NO3-、Cl- | |
| B. | 在pH=4的溶液中:Na+、K+、OH-、Cl- | |
| C. | 在含Ba2+的溶液中:H+、Na+、Cl-、SO42- | |
| D. | 与Fe反应产生气体的溶液:Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
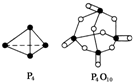 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能kJ/mol | 197 | 360 | 499 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
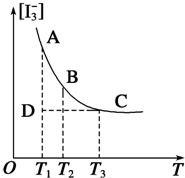 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
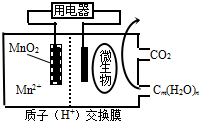
| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
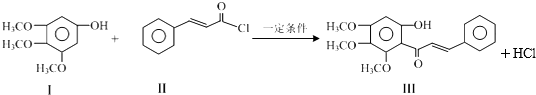
| A. | I的分子式为C9H10O4 | |
| B. | II中所有原子有可能均共面 | |
| C. | 可用FeCl3溶液鉴别有机物I和III | |
| D. | 1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com