
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
分析 由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,结合元素周期律解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl.
A.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,则最高价氧化物对应水化物的酸性:W>Z,故A正确;
B.同周期元素从左到右原子半径逐渐减小,电子层越多原子半径越大大,则原子半径Z>W>X>Y,故B错误;
C.4种元素的单质中,Z单质硫为固体,其它三种为气体,故Z单质的熔、沸点最高,故C正确;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g NO2含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
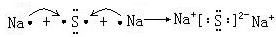 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与钠反应放出氢气 | B. | 能与新制的Cu(OH)2悬浊液反应 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 能发生加聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
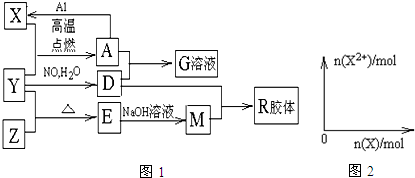
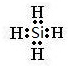 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com