
![]() (6分)某工厂用
(6分)某工厂用![]() 溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:
溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:![]() ======
======![]() 。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取10mL废液,加入足量的![]() 溶液,析出沉淀8.6l g。
溶液,析出沉淀8.6l g。
③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g
再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)根据有关数据计算该厂使用的![]() 溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
(3)10mL废液中铜离子的物质的量是 mol。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解
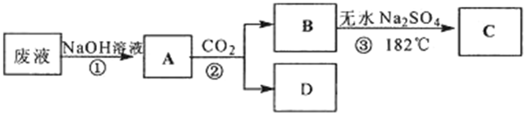
 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3
|
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为 ;
Ⅱ.已知:
H2O(g)=H2(g)+ O2(g) △H1 = +242 kJ·mol-1
Mg(s)+2 H2O(g)=Mg(OH)2(s) + H2(g) △H2 = -441 kJ·mol-1
Mg(s)+ O2(g)=MgO(s) △H3= -602kJ·mol-1
(2)氢氧化镁分解的热化学方程式为 ;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁。
(3)步骤①中加入保险粉的作用: 。
(4)已知EDTA只能与溶液中的反应生成易溶于水的物质,不与
反应。虽然
难溶于水,但步骤②中随着EDTA的加入,最终能够将
除去并获得纯度高的
。请从沉淀溶解平衡的角度加以解释 ;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(15分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为 ;
Ⅱ.已知:
H2O(g)=H2(g)+ 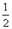 O2(g)
△H1 = +242 kJ·mol-1
O2(g)
△H1 = +242 kJ·mol-1
Mg(s)+2 H2O(g)=Mg(OH)2(s) + H2(g) △H2 = -441 kJ·mol-1
Mg(s)+ 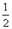 O2(g)=MgO(s)
△H3
= -602kJ·mol-1
O2(g)=MgO(s)
△H3
= -602kJ·mol-1
(2)氢氧化镁分解的热化学方程式为 ;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁。

(3)步骤①中加入保险粉 的作用:
。
的作用:
。
(4)已知EDTA只能与溶液中的 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与 反应。虽然
反应。虽然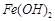 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将 除去并获得纯度高的
除去并获得纯度高的 。请从沉淀溶解平衡的角度加以解释
;
。请从沉淀溶解平衡的角度加以解释
;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
|
精制阻燃剂的条件 |
阻燃剂铁含量 |
|||
|
序号 |
提纯体系温度/℃ |
加入EDTA质量/g |
加入保险粉质量/g |
W(Fe)/(10-4g) |
|
1 |
40 |
0.05 |
0.05 |
7.63 |
|
2 |
40 |
0.05 |
0.10 |
6.83 |
|
3 |
60 |
0.05 |
0.10 |
6.83 |
|
4 |
60 |
0.10 |
0.10 |
6.51 |
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)某工厂用![]() 溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:
溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:![]() ======
======![]() 。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取10mL废液,加入足量的![]() 溶液,析出沉淀8.6l g。
溶液,析出沉淀8.6l g。
③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g
再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)根据有关数据计算该厂使用的![]() 溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
溶液中溶质的物质的量浓度(假设腐蚀电路板后溶液体积不变。写出计算过程)。
(3)10mL废液中铜离子的物质的量是 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com