
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:填空题
(16分)醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
实验 编号 | 温度 (K) | 盐酸浓度 (mol·L-1) | 醋酸浓度 (mol·L-1) | 实验目的 |
a | 298 | 0.20 |
| I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
b | 308 | 0.20 |
| |
c | 298 | 0.40 |
| |
d |
|
|
|
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
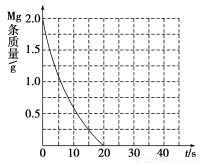
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+ O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+ O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.K+、Ca2+、Cl-、SO42- B.Fe2+、H+、CO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42- D.H+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C.硫酸铜水溶液里加入氨水生成的沉淀是氢氧化铜,继续加氨水沉淀又溶解,说明氢氧化铜是两性氢氧化物。
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层8电子结构的是
A.二氧化氮 B.光气(COCl2) C.二氟化氙 D.三氟化硼
查看答案和解析>>
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:选择题
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+1/2O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+1/2O2(g) CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
查看答案和解析>>
科目:高中化学 来源:2015届安徽省六校教育研究会高三第一次联考化学试卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
A.在该条件下,反应前后的压强之比为6 :5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.1 化学反应速率试卷(解析版) 题型:选择题
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应的化学方程式(Z用X、Y表示)是( )
A.X2+2Y2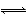 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2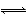 2X2Y
2X2Y
C.X2+3Y2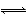 2XY3 D.3X2+Y2
2XY3 D.3X2+Y2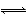 2X3Y
2X3Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com