
| A. | ①④⑤⑥ | B. | ④⑤⑥⑦ | C. | ①②③④ | D. | 全部 |
分析 部分电离、溶液中存在电离平衡的电解质为弱电解质,利用酸不能完全电离或盐类水解的规律来分析HNO2是弱电解质.
解答 解:①常温下HNO2溶液的pH小于7,只能证明其为酸,不能证明其为弱酸,故①错误;
②溶液的导电性与离子浓度成正比,用HNO2溶液做导电实验,灯泡很暗,只能说明溶液中离子浓度很小,不能说明亚硝酸的电离程度,所以不能证明亚硝酸为弱电解质,故②错误;
③HNO2和NaCl不能发生反应,只能说明不符合复分解反应的条件,但不能说明是弱酸,故③错误;
④常温下0.1 mol•L-1 HNO2溶液的pH=2.1,说明亚硝酸不完全电离,溶液中存在电离平衡,所以能说明亚硝酸为弱酸,故④正确;
⑤强酸可以制取弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2的酸性弱于H3PO4,所以能说明亚硝酸为弱酸,故⑤正确;
⑥常温下pH=1的HNO2溶液稀释至100倍,pH约为2.8说明亚硝酸中存在电离平衡,则亚硝酸为弱电解质,故⑥正确;
⑦常温下亚硝酸钠溶液的pH大于7,说明亚硝酸钠为强碱弱酸盐,所以能说明亚硝酸为弱酸,故⑦正确;
故选B.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO32-、Cl-、NO3- | B. | H+、NH4-、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下反应的平衡常数为1.6×103 | |
| B. | 通常情况下,该反应一定能自发进行 | |
| C. | 题给条件下,SO2的转化率是80% | |
| D. | 当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是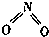 和
和 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com