
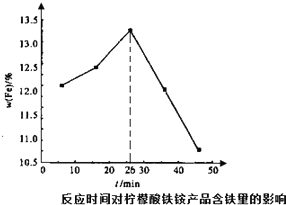
 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下: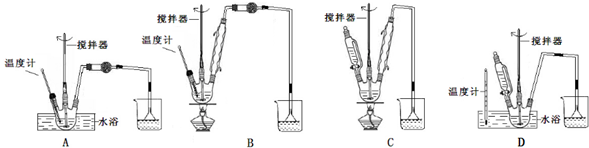
分析 柠檬酸铁铵制备:在酸性条件下氯酸钠氧化硫酸亚铁,反应方程式为:NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O,加入氨水,硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,反应方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4,加入柠檬酸发生Fe(OH)3+C6H5O7H3(柠檬酸)═Fe(C6H5O7)(柠檬酸铁)+3H2O,加入氨水,发生3NH3•H2O+C6H5O7H3(柠檬酸)═(NH4)3C6H5O7(柠檬酸铵)+3H2O,Fe(C6H5O7)+(NH4)3C6H5O7═(NH4)3Fe(C6H5O7)2(柠檬酸铁铵),制得柠檬酸铁铵.
(一)(1)氯酸钠氧化硫酸亚铁,需温度控制在80℃,比较装置的异同以及反应的条件选择所需仪器;
(2)亚铁离子可以用KSCN溶液和氯水、高锰酸钾溶液、K3[Fe(CN)6]检验,比较;
(3)根据题干信息:反应时间过长,产生结构紧密的氢氧化铁,难以被柠檬酸溶解进行解答;
(4)氢氧化铁未完全洗涤干净,含有杂质离子硫酸根离子,根据硫酸根离子的检验方法进行检验;
(二)(5)A.铁离子水解生成氢氧化铁和氢离子,NaClO3氧化Fe2+,消耗H+,促进产生的Fe3+水解;
B.硝酸具有强氧化性,能氧化产物氯离子生成氯气,同时引入杂质离子;
C.大多数固体溶解度随着温度的升高而升高;
D.稀硫酸能和氢氧化铁反应;
(6)从溶液中获取固体溶质,通常采用蒸发浓缩、冷却结晶、过滤,洗涤干燥得到成品;
(7)无水乙醇属于常用的有机溶剂,易挥发.
解答 解:(一)(1)A.在酸性条件下氯酸钠氧化硫酸亚铁,反应方程式为:NaClO3+6FeSO4+3H2SO4=NaCl+3Fe2(SO4)3+3H2O,氯酸钠氧化硫酸亚铁,无需球形干燥管进行干燥,故A错误;
B.氯酸钠氧化硫酸亚铁,需温度控制在80℃,装置B用酒精灯加热,不便于控制温度,反应中无需用冷凝管冷凝反应物、产物,故B错误;
C.氯酸钠氧化硫酸亚铁,需温度控制在80℃,装置C无温度计,故C错误;
D.用温度计控制水浴的温度,符合氯酸钠氧化硫酸亚铁80℃的要求,因需酸化,图中左部分有加液器需加硫酸,有防止倒吸的装置,防止副产物二氧化硫等易溶于水的物质溶于水产生倒吸,符合条件,故D正确;
故答案为:D;
(2)亚铁离子与KSCN溶液不反应,先加KSCN溶液,无现象,再加氯水变红,可检验亚铁离子,酸性高锰酸钾溶液能被亚铁离子还原而使酸性高锰酸钾溶液褪色,可检验亚铁离子,亚铁离子和铁氰化钾反应3Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,生成蓝色沉淀,所以亚铁离子可以用K3[Fe(CN)6]检验,现象最明显,D最合适,
故答案为:D;
(3)加入氨水,硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,反应方程式为:Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4,26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量,
故答案为:26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量;
(4)硫酸铁和一水合氨发生复分解反应生成氢氧化铁沉淀和硫酸铵,氢氧化铁未完全洗涤干净,含有杂质离子硫酸根离子,检验氢氧化铁是否完全洗涤干净,取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl2、AgNO3溶液,均无白色沉淀产生,证明洗涤干净,
故答案为:取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl2、AgNO3溶液,均无白色沉淀产生,证明洗涤干净;
(二)(5)A.Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,第①步用大量的NaClO3氧化Fe2+时,可消耗H+,促进产生的Fe3+水解产生Fe(OH)3,故A正确;
B.第①步中的NaClO3,若用稀硝酸溶液代替,稀硝酸氧化产物中的氯离子生成氯气,硫酸铁中混有硝酸铁,故B错误;
C.采用搅拌可加快固体溶解,适当升高温度也能加快Fe(OH)3的溶解速率,故C正确;
D.第③步中的柠檬酸是起调节溶液pH作用,不用稀硫酸代替,因稀硫酸能和氢氧化铁发生中和反应,故D错误;
故答案为:AD;
(6)柠檬酸铁铵溶于水,见光易转化为亚铁盐,通常采用蒸发浓缩、冷却结晶、过滤,洗涤干燥得到成品,
故答案为:蒸发浓缩、冷却结晶、过滤;
(7)在室温下,将所得的成品用无水乙醇进行浸泡2次,从而得到精制产品,选择用无水乙醇进行浸泡是因为:①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留,
故答案为:①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留.
点评 本题考查柠檬酸铁铵的制备、实验原理的分析及混合物的分离与提纯等实验基本操作,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0mL | 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加碱时出现白色沉淀,又逐渐溶解直至消失;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加碱时生成白色沉淀迅速变成灰绿色,最后变成红褐色;加酸后溶液变为黄色 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

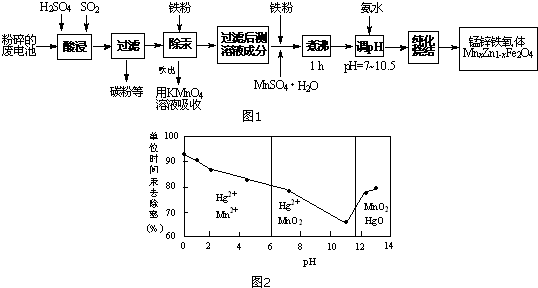
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
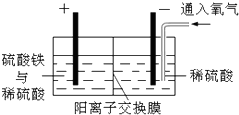 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
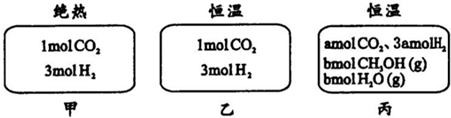
| A. | 刚开始反应时速率:甲<乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com